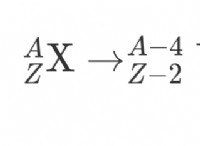1。蒸気圧力低下:
* 純粋な溶媒: 純粋な溶媒には特定の蒸気圧があり、これは液体の上の蒸気分子によって加えられる圧力です。 沸点では、蒸気圧は大気圧に等しくなります。
* 解決策: 溶質を追加すると、溶媒分子が蒸気相に逃げる能力を破壊します。これは、溶質粒子が邪魔になり、本質的に溶媒分子の一部を「抑制」するためです。 これにより、純粋な溶媒と比較して、溶液の *低い *蒸気圧が生じます。
2。より高い沸点:
* 沸騰する: 溶液を沸騰させるには、その蒸気圧は大気圧に等しくなる必要があります。
* 蒸気圧の低い温度: 溶液の蒸気圧は低いため、沸点で純粋な溶媒と同じ蒸気圧を達成するには、より高い温度に達する必要があります。 したがって、溶液の沸点は純粋な溶媒の沸点よりも高くなります。
このように考えてみてください:
人々が一本のドアから逃げようとしている混雑した部屋を想像してください。 部屋にいる人(溶質粒子)が多いほど、個人(溶媒分子)がドアに着いて逃げる(蒸発)が難しくなります。みんなを追い出すために、より強く押して(より多くの熱を塗る)必要があります!
キーポイント:
*この現象は沸点の標高と呼ばれます 。
*それは衝突特性です。つまり、溶質粒子の濃度のみに依存し、そのアイデンティティではありません。
*この効果は、不揮発性溶質(容易に気化しないもの)でより顕著です。
この説明のあらゆる側面についてもっと詳細をご希望の場合はお知らせください!