主な違い - 分圧と蒸気圧
圧力とは、ある物質が別の物質の単位面積に加える力です。分圧と蒸気圧は、物質に関連する 2 種類の圧力です。分圧と蒸気圧の主な違いは、分圧はガス混合物中の個々のガスによって加えられる圧力です。 一方、蒸気圧は、凝縮した形で平衡状態にある蒸気によって加えられる圧力です。
対象となる主な分野
1.分圧とは
– 定義、特性、計算
2.蒸気圧とは
– 定義、特徴、影響する要因
3.分圧と蒸気圧の違いは何ですか
– 主な違いの比較
重要な用語:圧力、蒸気、モル分率、分圧、気化、揮発性化合物、運動エネルギー 
分圧とは?
分圧に関する概念は、科学者のジョン・ダルトンによって最初に提案されました。これは、混合ガス中の個々のガスによって与えられる圧力として定義されます。次に、その混合ガスの全圧は、すべてのガスの分圧の合計です。したがって、ガスの分圧は常にそのシステムの全圧よりも低い値になります。
たとえば、大気圧は、大気中にあるすべてのガスの分圧の合計です。分圧は以下のように計算されます。 「X」という名前のガスを考えると、
X の分圧 =X のモル分率 * 全圧
したがって、ガスの分圧は特定のガスのモル分率に比例します。
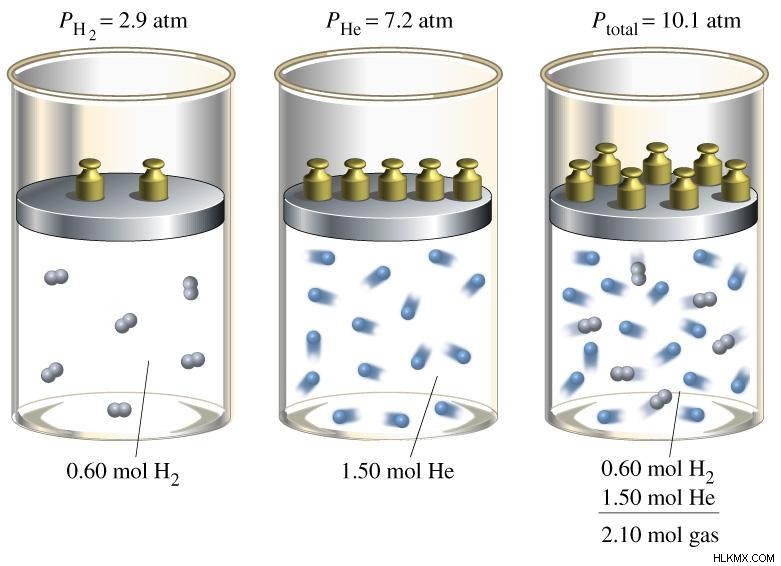
図 01:水素 (H2) とヘリウム (He) ガスの混合ガスの分圧
蒸気圧とは?
蒸気圧は、凝縮した形 (液相または固相) と平衡状態にある蒸気によって加えられる圧力です。しかし、蒸気圧を考えると、蒸気が存在する系は一定温度の閉鎖系でなければなりません。蒸気圧は、液体分子 (または固体) が閉鎖系の空気に逃げることによって発生します。
蒸気圧は液体分子の脱出に関係しているため、低温で蒸気圧が高い物質は揮発性化合物と呼ばれます。蒸気の形成は気化と呼ばれます。気化は、物質の液相と固相の両方から発生する可能性があります。
蒸気圧は、システムの温度変化によって変化します。温度を上げると、液面から逃げる液体分子の割合が増加します。これは、液体分子のキネシス (運動エネルギー) が増加するために発生します。したがって、蒸気圧もそれに応じて増加します。
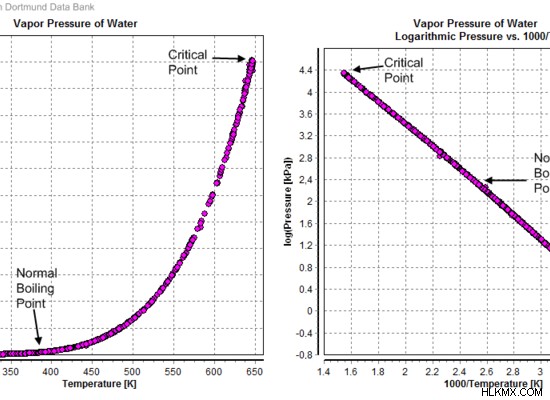
図 02:蒸気圧と温度の関係
蒸気圧がシステム内の外圧と等しくなるポイントになると、液体は沸騰します。
蒸気圧に影響する要因
分子の種類
固体または液体を構成する分子は、系の蒸気圧に影響を与えます。たとえば、分子間の相互作用が強ければ、蒸気圧は低くなります。これは、分子が逃げにくくなるためです。
気温
システムの温度が高ければ蒸気圧も高くなり、温度が低ければ蒸気圧も低くなります。
表面積
蒸気圧に対する表面積の影響はありません。
分圧と蒸気圧の違い
定義
分圧: 分圧は、混合ガス中の個々のガスから生じる圧力です。
蒸気圧: 蒸気圧は、蒸気が凝縮した形 (液体または固体) に加える圧力です。
物理的状態
分圧: 分圧は気相のみに関係します。
蒸気圧: 蒸気圧は、固相と液相に関連しています。
ボリューム
分圧: 分圧は、同じ体積に存在するガスに対して計算されます。
蒸気圧: 蒸気圧は、システムの体積や固体または液体の表面積には依存しません。
モル分率
分圧: 分圧を計算するとき、特定のガスのモル分率が考慮されます。
蒸気圧: 蒸気圧では、溶質分子がその系で蒸気を形成するため、溶質のモル分率が考慮されます。
結論
分圧と蒸気圧は、ガス成分がそれを含むシステムに及ぼす力を決定するために使用される 2 つの用語です。分圧と蒸気圧の主な違いは、分圧はガス混合物中の個々のガスの圧力であるのに対し、蒸気圧は凝縮した形と平衡にある蒸気の圧力であることです。
参考文献:
1.「蒸気圧式」。算数。 N.p.、n.d.ウェブ。こちらから入手できます。 2017 年 6 月 9 日。
2. 「ダルトンの分圧の法則 – 無限に開かれた教科書」無限。こちらから入手できます。 2016 年 8 月 8 日。ウェブ。 2017 年 6 月 9 日。
画像提供:
1. ブレア・ジェシー・エリン・ライヒ博士による「Presiones parciales」 – (CC BY-SA 3.0) Commons Wikimedia経由/P>