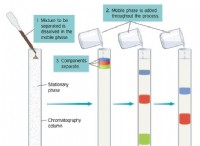
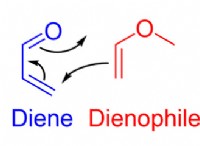
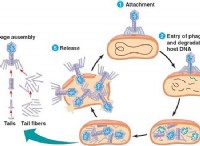
1。価電子と反応性:
* 価電子: これらは、原子の最も外側のエネルギーレベルの電子です。彼らは化学結合に関与しているものです。
* 反応性: 原子は、通常、原子価電子を獲得、紛失、または共有して完全な外側のシェル(ほとんどの要素の場合)を獲得、紛失、または共有することにより、安定した電子構成を達成する方法で反応する傾向があります。
* 例: ナトリウム(Na)には1つの原子価電子があります。この電子を容易に失い、正に帯電したイオン(Na+)になり、Neon(NE)のような安定した構成を達成します。塩素(Cl)には7つの原子価電子があります。電子を容易に獲得して負に帯電したイオン(CL-)になり、Argon(AR)のような安定した構成も実現します。
2。エネルギーレベルと化学結合:
* エネルギーレベル: 電子は、原子内の特定のエネルギーレベルを占めます。エネルギーレベルが高いということは、電子が核から遠くにあることを意味し、それほど密接に結合していません。
* 結合形成: 原子が化学結合を形成するとき、それは電子を共有または伝達することにより、より低いエネルギー状態を達成できるためです。結合に関与する電子は、通常、最高のエネルギーレベル(価数シェル)から来ています。
* 例: 共有結合(電子の共有)では、両方の原子が価電子シェルを埋めることでより低いエネルギー状態を達成できます。イオン結合(電子移動)では、電子を失う原子はより安定し(低エネルギー)、電子を獲得する原子もより安定します。
3。電子構成と化学的挙動:
* 反応性の予測: 原子の電子構成を知ることは、その化学的挙動を予測するのに役立ちます。たとえば、周期表の同じグループ(列)の要素は同様の電子構成を持っているため、同様の反応性を示します。
* 定期的な傾向: 周期表は、電子構成に基づいて要素を整理し、反応性、イオン化エネルギー、電気陰性度などの傾向を理解できるようにします。
* 例: アルカリ金属(グループ1)は1つの原子価電子を持ち、非常に反応性があり、その電子を容易に失い、正のイオンを形成します。ハロゲン(グループ17)には7つの価電子があり、非常に反応性があり、電子を容易に獲得して負イオンを形成します。
要約:
電子の構成とエネルギーレベルは、化学反応性を理解する基盤です。原子内の電子の数と配置は、それが他の原子とどのように相互作用するかを決定し、最終的に化学結合と全体的な反応性を形成する傾向を決定します。