基本的なアイデア:
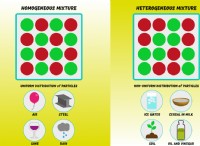
* 極性: 溶解度を理解するための鍵は、極性の概念です。 分子は、極性(不均一な電荷分布を有する)または非極性(均一な電荷分布を持つ)にすることができます。
* 極分子: 水(h₂o)を考えてください - 酸素端はわずかに陰性であり、水素端はわずかに陽性です。
* 非極性分子: 油について考えてください - 炭素と水素の原子は電子を等しく共有するので、電荷の分離はありません。
* "like"は同様のことを意味します: この原則は、同様の極性のある物質が互いに溶解する傾向があると述べています。
* 極性溶媒は極性溶質を溶解します: 極性溶媒である水は、極性溶質である砂糖を容易に溶解します。
* 非極性溶媒は非極性溶質を溶解します: 非極性溶媒であるオイルは、非極性溶質であるグリースを溶解します。
なぜこれが機能するのか?
* 分子間力: 分子間の魅力(分子間力)は重要な役割を果たします。
* 極分子 強力な水素結合または双極子双極子相互作用を形成します。これらの相互作用は、他の極性分子を溶解するのに役立ちます。
* 非極性分子 弱いロンドン分散勢力を形成します。これらの力は、非極性溶媒が非極性溶質を溶解する理由でもあります。
例:
* 水(極)塩を溶解する(イオン、極): 塩イオン(Na⁺およびCl⁻)は極水分子に引き付けられ、イオン結合を分解し、塩が溶解するようにします。
* オイル(非極性)溶解グリース(非極性): オイルとグリースの両方は、非極性の炭化水素の長い鎖で構成されています。それらの間の弱いロンドン分散力は、簡単に混合できます。
* 水(極)はオイルを溶解しません(非極性): 水分子内の強い相互作用は、非極性油分子との弱い相互作用によって容易に破壊されることはありません。 それらは別々のままです。
例外と考慮事項:
* 中間極性: 一部の分子には極性が混在しています(例:エタノール)。極性溶媒と非極性溶媒の両方に溶解することができますが、溶解度は制限される可能性があります。
* 温度: 溶解度は温度とともに増加することがよくあります。温度が上昇するにつれて、溶質を保持する分子間の力を壊すためにより多くのエネルギーが利用可能になります。
* 圧力: 圧力は、液体や固体よりもガスの溶解度に大きな影響を与えます。圧力の増加は、一般にガスの溶解度を高めます。
要約: 溶解度を予測するためには、「ような溶解のような」の原則を理解することが不可欠です。溶媒と溶質の極性を考慮することにより、物質が特定の溶媒に溶解するかどうかについて情報に基づいた決定を下すことができます。