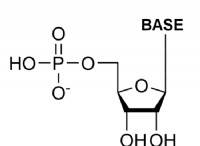
金属の場合:
* イオン化エネルギー: 金属は一般に *低い *イオン化エネルギーを持っています。つまり、電子を失い、陽性イオンを形成しやすくなります。これにより、それらはより反応的になります。
* 電気陰性度: 金属は電気陰性度を *低く *、電子を引き付ける可能性が低いことを示しています。これはまた、電子を失う傾向に貢献します。
* 周期表の位置:
* 期間にわたる: 左から右に移動すると、反応性が低下します。これは、イオン化エネルギーが増加し(電子を失うのが難しい)、電気陰性度が増加する(電子を引き付ける可能性が高い)ためです。
* グループのダウン: 一般に、グループを下ると反応性が増加します。これは、最も外側の電子が核から遠くにあるため、それらを除去しやすくするためです。
* 例外: 特に電子構成の影響と遷移金属におけるD軌道の存在のために、これらの傾向には例外があります。
非金属の場合:
* 電子親和性: 非金属は一般に、電子親和性を *高い * *高い *を持っています。つまり、電子を獲得して陰イオンを形成する傾向があります。これにより、それらはより反応的になります。
* 電気陰性度: 非金属には電気陰性度が高い *高 *があるため、電子を引き付ける可能性が高くなります。これはさらにそれらの反応性に貢献します。
* 周期表の位置:
* 期間にわたる: 一般に、反応性は左から右に移動するにつれて増加します。これは、電子の親和性と電気陰性度が増加し、電子を獲得しやすくするためです。
* グループのダウン: 一般に、グループを下ると反応性が低下します。これは、最も外側の電子が核から遠くにあるため、それらを獲得する可能性が低くなっているためです。
要約:
* 金属: 低いイオン化エネルギー、より低い電気陰性度とより反応性が高く、周期表の左下でより反応性が高い傾向があります。
* 非金属: より高い電子親和性、より高い電気陰性度により反応性が高い傾向があり、周期表の右上でより反応性があります。
これらの傾向には例外があり、特定の要因があらゆる要素の反応性に影響を与える可能性があることを忘れないでください。反応性を評価する際には、コンテキストと個々の特性を考慮することが重要です。