主な違い – 付加反応と置換反応
付加反応、置換反応、脱離反応は有機化学の基本的な反応です。ほとんどの化学合成と同定は、これらの反応に基づいています。これらの反応は、1 段階または 2 段階で発生します。付加反応と置換反応の主な違いは、付加反応には 2 つ以上の原子または官能基の組み合わせが含まれることです。 一方、置換反応は、別の官能基による原子または官能基の置換を伴います。
対象となる主な分野
1. 付加反応とは
– 定義、分類、特徴、例
2. 置換反応とは
– 定義、分類、特徴、例
3. 付加反応と置換反応の違いは何ですか
– 主な違いの比較
重要な用語:付加反応、付加物、環化付加、求電子、求電子付加、求電子置換、フリーラジカル付加、脱離基、非極性付加反応、求核試薬、求核付加、求核置換、極性付加反応、ラジカル置換、置換反応、基質
付加反応とは
付加反応は、大きな分子を形成するために 2 つ以上の原子または分子が結合することです。この大きな分子は付加物として知られています .ほとんどの付加反応は、二重結合または三重結合のいずれかを持つ不飽和分子に限定されます。これらの付加反応は次のように分類できます。
付加反応の分類
- 極性付加反応
- 求電子付加
- 求核付加
- 無極性付加反応
- フリーラジカル付加
- 循環加算
求電子付加
求電子付加は、求電子試薬と分子の組み合わせです。求電子剤は、電子が豊富な種から電子対を受け取り、共有結合を形成できる原子または分子です。より多くの電子を受け入れるために、求電子剤は正または中性に帯電しており、入ってくる電子のための自由軌道を持っています。付加反応による副生成物はありません。

図 01:求電子付加
上の例では、H が求電子剤として機能します。正に帯電しています。二重結合のパイ結合は電子が豊富です。したがって、求電子剤 (H) は二重結合を攻撃し、電子を取得してその電荷を中和します。上記の例では、新しく形成された分子は求電子剤です。したがって、求電子付加反応を受けることもあります。
求核付加
求核付加は、求核試薬と分子の組み合わせです。求核試薬は、電子対を供与できる原子または分子です。求核剤は、求電子剤に電子を供与できます。 π 結合を持つ分子、自由電子対を持つ原子または分子は、求核試薬として機能します。
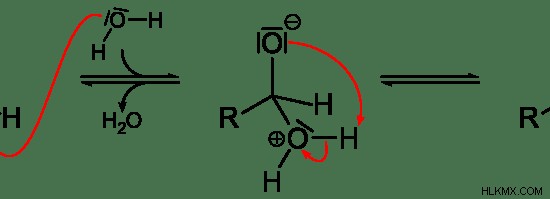
図 02:求核付加
上の画像では、「H2」 O" は求核試薬であり、酸素原子に孤立電子対があります。 C 原子は –C=O 結合の極性により部分的に正電荷を持っているため、中心の炭素原子に結合できます。
フリーラジカル付加
フリーラジカル付加は、2 つのラジカルの間、またはラジカルと非ラジカルの間で発生する可能性があります。ただし、フリーラジカルの付加は次の 3 つのステップで発生します。
<オール>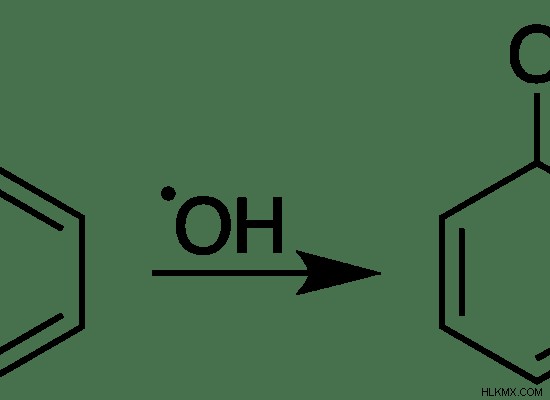
図 03:「.OH」ラジカルとベンゼンとの反応は、新しいラジカルを形成します。
循環加算
2 つの環状または非環状分子の組み合わせによる環状分子の形成は、環状付加として知られています。 Diels-Alder 反応は環状付加の良い例です。
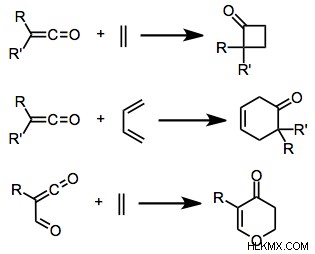
図 4:環状加算の例
上の画像は、カルボン酸化合物とアルケンの付加を示しています。これらの付加により、環状化合物が形成されました。
置換反応とは
置換反応は、原子または原子群を別の原子または原子群で置換する反応です。これにより、離脱グループという名前の副産物が生じます .置換反応の大まかな分類(置換基の種類による)は以下の通りです。
- 求電子置換
- 求核置換
- ラジカル置換
求電子置換
求電子置換は、求電子剤による原子または官能基の置換です。ここでも、求電子剤は、電子が豊富な種から電子対を受け取ることができ、正電荷または中性電荷のいずれかを持つことができる原子または分子です。

図 05:NO2+ からベンゼンへの求電子置換
上の例では、ベンゼン環の 1 つの水素原子が NO2 に置換されています。 .ほら、NO2 グループは、正に帯電した求電子剤として機能します。水素原子は脱離基です。
求核置換
求核置換は、求核剤による原子または官能基の置換です。ここでも、求核試薬は、電子対を供与できる原子または分子であり、負電荷または中性電荷を持っています。
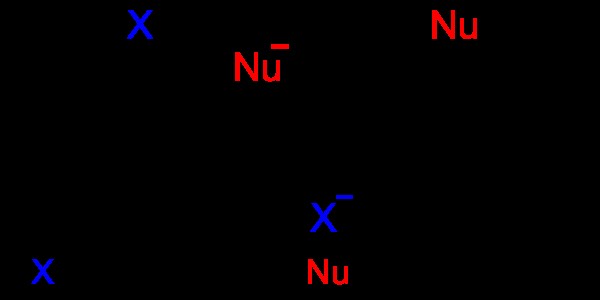
図 06:芳香族求核置換
上の画像では、「Nu」は求核剤を示し、芳香族分子の「X」原子を置き換えます。 「X」原子は脱離基です。
ラジカル置換
ラジカル置換には、ラジカルと基質の反応が含まれます。ラジカル置換も、反応が完了するまでに少なくとも 2 つのステップ (ラジカル付加反応と同じ) が含まれます。ほとんどの場合、3 つのステップが関係します。
<オール>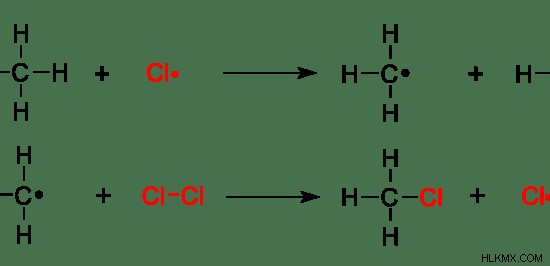
図 7:メタンのラジカル置換
上の例では、メタンの水素原子が「Cl」ラジカルに置き換えられています。水素原子は脱離基です。
付加反応と置換反応の違い
定義
付加反応: 付加反応は、大きな分子を形成するための 2 つ以上の原子または分子の組み合わせです。
置換反応: 置換反応は、原子または原子群を別の原子または原子群で置換する反応です。
最終分子
付加反応: 付加反応の後に形成される大きな分子は付加物と呼ばれます。
置換反応: 求電子剤または脱離基を除いた分子の部分は、基質と呼ばれます。
副産物
付加反応: 付加反応で副生成物が生成されません。
置換反応: 副生成物は、置換反応で形成されます。副産物は脱退グループです。
基質または付加物のモル質量
加算反応: 付加反応における付加物のモル質量は、新しい原子または基の結合により、最初の分子のモル質量よりも常に増加します。
置換反応: 置換反応における基質のモル質量は、置換基に応じて、最初の分子のモル質量よりも増加または減少する可能性があります。
結論
付加および置換反応は、有機化学の反応メカニズムを説明するために使用されます。付加反応と置換反応の主な違いは、付加反応には2つ以上の原子または官能基の組み合わせが含まれるのに対し、置換反応には別の官能基による原子または官能基の置換が含まれることです。
画像提供:
1. 「求電子付加ヒドロン機構」Omegakent – Commons Wikimedia 経由の自身の作品 (パブリック ドメイン)
2. 「アルデヒド水和物の形成」Sponk 著(話) – Commons Wikimedia 経由の自作(パブリック ドメイン)
3. DMacksによる「ベンゼンヒドロキシル反応」(トーク)–コモンズウィキメディア経由の自作(パブリックドメイン)
4. OrganicReactions による「KetGen」 – Commons Wikimedia 経由の自身の作品 (CC BY 3.0)
5. 「ベンゼンニトロ化メカニズム」Benjah-bmm27 著 – Commons Wikimedia 経由の自身の作品 (パブリック ドメイン)
6. 「芳香族求核置換」パブリック ドメイン)、コモンズ ウィキメディア経由
7.英語版ウィキペディアの V8rik による「メタン塩素化プロパゲーションステップ」(CC BY-SA 3.0)、コモンズ ウィキメディア経由