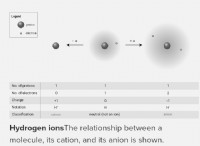
* 単原子イオン 電子を獲得または失った単一原子であり、正味の正または負の電荷をもたらします。
* 共有結合 2つ以上の原子間で電子を共有することを伴います。
ここに故障があります:
* 単原子イオン イオン結合によって形成されます 。イオン結合では、1つの原子(通常は金属)が電子を失い、正に帯電した陽イオンになり、別の原子(通常は非金属)が電子をゲインし、負に帯電した陰イオンになります。反対に帯電したイオン間の静電引力は、それらをイオン化合物にまとめます。
* 共有結合 原子が電子を共有してより安定した電子構成を実現するときに形を形成します。このタイプの結合は通常、非金属間で発生します。
例:
* 単原子イオン: ナトリウム原子から1つの電子の損失によって形成されるナトリウムイオン(Na+)。
* 共有結合分子: 水(H₂O)、水素と酸素原子が電子を共有している。
要約: 単原子イオンは、共有結合ではなく、イオン結合によって形成されます。それらは、電子の獲得または損失のために正味電荷の単一原子です。