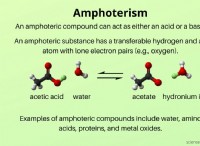
その理由は次のとおりです。
* 価電子: これらは最も外側のシェルの電子であり、化学結合に参加する電子です。
* 結合形成: 原子が価電子電子を共有または伝達すると、結合が形成されます。 この共有または転送は、両方の原子が完全な外側シェル(多くの場合8電子を持つ)を持つ安定した配置を作成します。
例: 水のような単純な分子(H₂O)を考えてみましょう。
* 酸素: 酸素には6つの価電子があります。完全な外側のシェルを持つには、さらに2つ必要です。
* 水素: 各水素原子には1つの価電子があります。完全な外側のシェルを持つには、さらに1つ必要です。
* 結合: 酸素は、その原子価電子のうち2つを2つの水素原子と共有し、2つの共有結合を形成します。これにより、すべての原子が完全な外側シェルを持つ安定した分子になります。
したがって、原子内のすべての電子は原子構造の一部ですが、結合形成に積極的に関与するのは、原子価シェルの電子です。