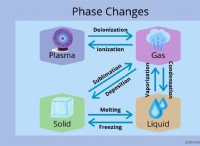
アルカリ金属(グループ1)
* 電子構成: アルカリ金属には、最も外側のシェルに1つの価電子があります。
* 反応性: 彼らはこの単一の電子を容易に失い、+1陽イオンを形成し、前の貴族と同様の安定した電子構成を達成します。これにより、特に水と非金属で非常に反応性が高くなります。
* 例: ナトリウム(NA)は水と激しく反応し、水素ガスを放出し、水酸化ナトリウム(NAOH)を形成します。
ハロゲン(グループ17)
* 電子構成: ハロゲンには、最も外側のシェルに7つの価電子があります。
* 反応性: 彼らは容易に1つの電子を獲得して-1アニオンを形成し、次の貴重なガスと同様の安定した電子構成を達成します。 これにより、特に金属では非常に反応性が高くなります。
* 例: 塩素(Cl)はナトリウム(NA)と反応して、一般的なテーブル塩である塩化ナトリウム(NaCl)を形成します。
反応性の概要:
* アルカリ金属: 1つの電子を失い、正に帯電したイオンになる傾向があるため、高反応性。
* ハロゲン: 1つの電子を獲得し、負に帯電したイオンになる傾向があるため、高反応性。
反応性に影響する他の要因:
* 電気陰性度: アルカリ金属は電気陰性度が低く、電子を容易に失います。ハロゲンは電気陰性度が高く、電子を容易に獲得します。
* イオン化エネルギー: アルカリ金属のイオン化エネルギーは低いため、電子を除去するのにエネルギーが少ないことを意味します。ハロゲンは電子親和性が高いため、電子を獲得すると大量のエネルギーを放出します。
結論として、アルカリ金属とハロゲンの反応性は、電子構成と、貴族の安定した電子構成を達成する傾向から生じます。 これらの特性により、多くの化学反応や産業プロセスにおける重要な成分があります。