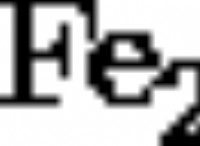なぜそれがどのように機能するかは次のとおりです。
反応速度の理解
* 反応速度: これは、反応がどれだけ速く進行するかの尺度です。通常、反応物または生成物の濃度の変化が時間の経過とともに変化すると表現されます。
* 化学量論係数: これらは、バランスの取れた化学式の各化学種の前の数値です。それらは、反応に関与する各物質の相対量を表します。
化学量論的係数で除算する理由
1。比較可能性: 反応物の消失速度は、化学量論により、製品の外観速度とは異なる場合があります。係数で割ると、レートが正規化され、直接匹敵することが保証されます。
2。反応率: 係数で割る後の結果の値は、しばしば「反応速度」と呼ばれます。この値は反応の全体的な速度を表し、考慮される特定の種とは無関係です。
例:
次の反応を検討してください。
`` `
2a + b→3c
`` `
* a:の消失率 -d [a]/dt
* bの消失率: -d [b]/dt
* cの外観率: d [c]/dt
これらのレートを比較するために、それぞれを対応する化学量論係数で除算します。
* 反応率=- (1/2)d [a]/dt =-d [b]/dt =(1/3)d [c]/dt
キーポイント:
* サインコンベンション: 消失率はマイナスですが、外観率はプラスです。
* 単位: 反応速度の単位は、通常、単位時間あたりの濃度として表されます(例:mol/l・s)。
* レート法: 反応速度は、多くの場合、速度則による反応物の濃度に関連しています。この法律は実験的に決定することができ、しばしば各反応物に対する反応の順序を反映する指数を含む。
要約すると、反応速度を化学量論係数で割ることは、化学動態の重要なステップです。これにより、反応における異なる種の変化率を比較し、全体的な反応速度を一貫した意味のある方法で表現することができます。