1。電子構成: 水素には1つのプロトンと1つの電子しかありません。これにより、1つの電子を獲得してヘリウムのようになり(完全な外側のシェルが付いた貴族ガス)、電子を失い、正に帯電したイオン(H+)になるため、非常に反応します。
2。高い電気陰性度: 水素はフッ素や塩素のようなハロゲンと比較して非常に電気陰性ではありませんが、多種多様な元素と共有結合を形成するのに十分な電気陰性です。これは、安定した構成を実現するために、他の原子と電子を共有できることを意味します。
3。小さな原子サイズ: 水素の小さなサイズにより、単一の電子に簡単にアクセスできるため、結合を容易に形成できます。
4。陽イオンとアニオンの形成:
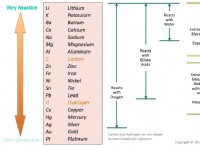
* cation層: 水素は、特にハロゲンのような強力な電気陰性要素と反応する場合、陽性イオン(H+)を形成するために電子を容易に失います。これは、HCl(塩酸)のようなイオン化合物の形成につながります。
* アニオン形成: 水素も電子を獲得して、水素化物イオンとして知られる負に帯電したイオン(H-)を形成することができます。これは、ナトリウムやカリウムなどの活性金属と反応し、NAH(水素化ナトリウム)のようなイオン水素化物を形成する場合によく見られます。
5。金属との反応性: 水素は、多くの金属、特にアルカリおよびアルカリのアース金属と反応して、イオン水素化物(NAH、CAH2など)を形成します。
6。非金属との反応性: 水素は酸素のような非金属と反応して、水(H2O)のような共有化合物を形成します。
要約: 安定した構成、その高い電気陰性度を達成するために電子を獲得または失うという水素の傾向、およびその小さなサイズにより、大部分の要素と非常に反応します。