Niel Bohr の原子理論では、原子は、電子が離散的にエネルギーを与えられた軌道に配置された惑星モデルのようなものであると述べています。励起された電子が高い軌道から低い軌道に飛び降りるとき、原子は光子を放射します。これらの軌道のエネルギーの差は、光子のエネルギーに等しくなります。
ニールス ボーアはデンマークの物理学者で、量子力学の創始者の 1 人と考えられており、正確には 古い 量子力学。彼の科学への模範的な貢献により、カールスバーグの醸造会社は、醸造所のすぐ隣にある家を彼に与えることにしました。家はパイプラインで醸造所に接続されていました。ボーアは、彼の気まぐれで蛇口から注ぎ出される無料のビールの生涯供給で報われました.ニールス ボーアは、この名誉ある栄誉、そしてノーベル賞に値する、どのような驚くべき偉業を成し遂げましたか?

ニールス・ボーア。 (写真提供:パブリック ドメイン / ウィキメディア コモンズ)
簡単に言えば、ニールス・ボーアは原子の神秘的な内部構造を明らかにしました。彼は、原子核の8月の創始者であるアーネスト・ラザフォードと協力して自分のモデルとその原理に到達しましたが、モデルはボーアの功績によるものです。元はラザフォード-ボーア原子モデルと呼ばれていましたが、現在は一般的にボーア原子モデルと呼ばれています。
ボーアの理論を理解するには、まず、どのような発見がボーアの革命的なアイデアの追求につながったかを理解する必要があります。
ラザフォードの失敗モデル
サー・J・Jでした。トムソンは、原子が結局は分割できないわけではないことを最初に発見しました。ただし、亜原子 彼が発見した粒子は負に帯電していました。原子が単なる負電荷の集まりだとしたら、椅子もテーブルもあなたも私も安定していません。彼はすぐに、物質の安定性を説明するには、負性を中和する正味の正電荷が必要であることに気付きました.
トムソンは原子の最初のモデルとなるものを考案しました。彼は、彼が電子と呼んだ負の粒子は、正に帯電したスイカに埋め込まれた種子のようなものであると示唆しました。このモデルは一般に プラム として知られています またはレーズンプリンモデル .類推は明らかだと思います。

この見解は、アーネスト・ラザフォードが、正の粒子が原子に向けて発射されると、ほとんどの粒子はまっすぐ通過するが、いくつかは大きな角度で偏向することが観察されることを示すまで、真実でした。ラザフォードは、原子の大部分が空のスペースで満たされていることに気付きましたが、中心には正電荷が点のように密集していました。彼はこれを原子核と呼んだ。原子の電子と原子核の間の空きスペースの体積は非常に大きいため、原子を野球場のサイズに拡大すると、その原子核は野球ボールのサイズになります。
ラザフォードは、おそらく原子系は、惑星が太陽の周りを回転するように電子が原子核の周りを回転する太陽系に類似していると示唆した.もちろん、決定的な違いは、電子が重力ではなく静電力によって捕らえられたことです。しかし、マクスウェルとヘルツは激しく反対したでしょう。

ラザフォードの惑星モデル。
マクスウェルの電磁気学の法則は、最近、電子などの荷電粒子の運動がエネルギーを犠牲にして行われることを確立しました。したがって、回転する電子は、バイクに乗ったサーカス団員が球体の中で走り回るように、すぐにらせん状になり、燃料がなくなると崩壊します。実際、物理学者は、電子がすべてのエネルギーを放射して原子核に崩壊するのにかかる時間はわずか 16 ピコ秒であると計算しました。それは 1 兆分の 1 秒です。物質の深い安定性を説明する新しい原子モデルはまだ発見されていませんでした.
水素スペクトル
当時の物理学者を困惑させたもう 1 つの不条理は、プランクの黒体放射と、さまざまな原子から放出される「発光スペクトル」でした。 「スペクトル」という言葉は、ニュートンが彼のプリズムから飛び出した色の虹を表すために最初に作り出したものです。
同様に、体が加熱されると、電磁エネルギーのスペクトルが放射されます。トーチで鉄の棒を燃やすと、棒の温度が上昇するにつれて、鉄の色も徐々に変化することがわかります。最初に赤、次にオレンジ、そして明るい白、そして紫に変わります。
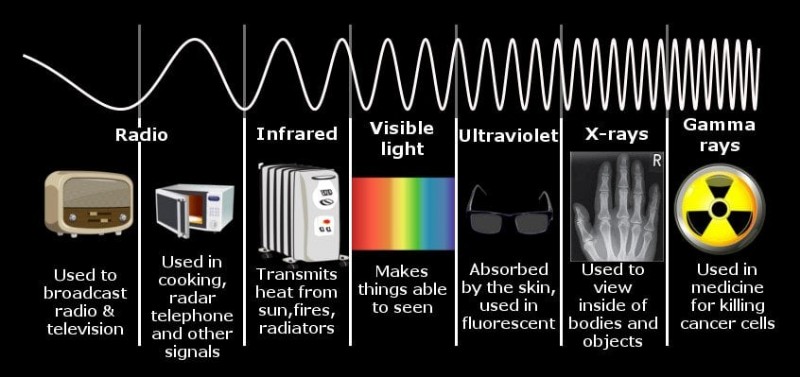
電磁スペクトル。
これは、その鉄の棒から放射される電磁エネルギーが、私たちの目が感知できる可視光の範囲にあるためです。バーを 20,000 ケルビンに加熱すると、放射されるエネルギーは紫外線 (UV) 範囲になります。実際、宇宙のすべての物体は、人間を含むこのようなスペクトルのエネルギーを放射していますが、私たちの体の温度は非常に低いため、放射されるエネルギーもわずかで、赤外線の範囲のどこかにあります.私たちの目には、電磁スペクトルのいくつかのメンバーの中から 1 つのメンバーだけを識別できるセンサーが装備されています。
マックス・プランクはこの現象を黒体放射と呼んだ。放射される光の波長で熱の強さをプロットすると、特定の範囲の波長でピークが観察されます。 6,000K で燃える太陽のコアのピークは部分的に可視範囲にあり、20,000K で燃えている星は完全に UV 範囲にあり、ブラック ホールの誕生などの星の爆発では、ガンマ範囲にあります。
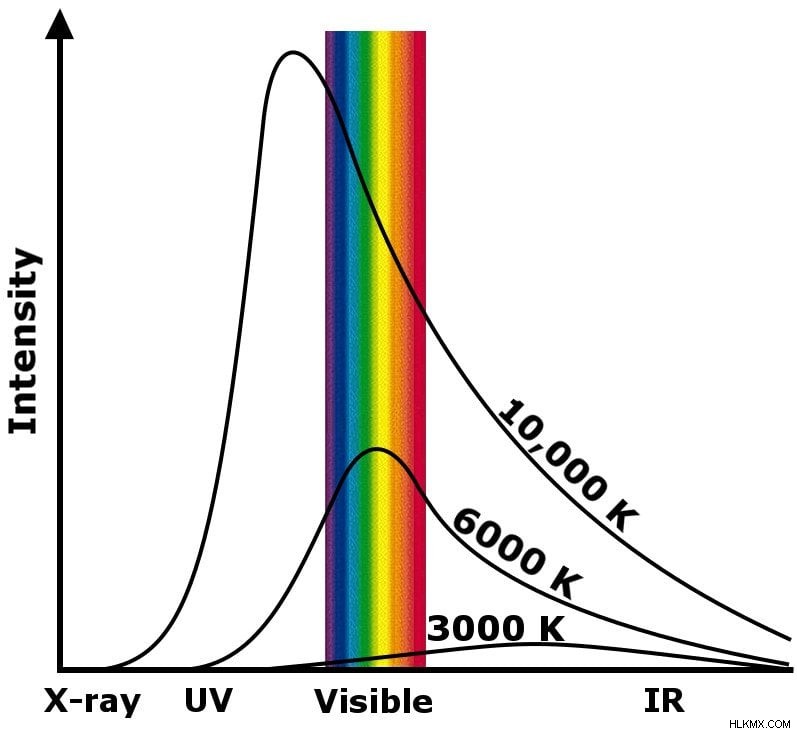
黒体放射
さらに、このグラフは、体の温度が下がると、体が放射する光の波長が長くなることを示しています。たとえば、ビッグバンからの放射線はガンマ線として始まった可能性がありますが、130 億年以上かけて冷却されると、波長がマイクロ波にまで伸びました。これらの波を黒の背景にプロットすると、美しくもやのかかった色のメランジ、つまり連続したスペクトルが表示されます。

連続スペクトル。 (写真提供:Stkl / ウィキメディア・コモンズ)
しかし、プランクの発見の主な意味は、放射エネルギーが、アインシュタインが後に光子と呼んだ、剛体粒子のような個別のパケットで移動したことでした。 単一の量子のエネルギー 波長に反比例するか、周波数に正比例します。プランク定数と呼ばれる比例の基本定数 h で 、エネルギー E 周波数 v E =hv. と表すことができます。
さて、この方法で単一元素のガスの体積を加熱し、黒い背景に色をプロットすると、何らかの異常が観察されます.スペクトルは、もはや美しい色や連続した色の混合物ではありません。代わりに、完全に黒い背景の塊によって断続的に分離された一連の明確な単色の線で構成されています。たとえば、有名な水素のスペクトルを見てみましょう。

水素のスペクトル。 (写真提供:パトリック・エドウィン・モラン / ウィキメディア・コモンズ)
実際、宇宙のすべての要素は、独自の不連続なスペクトルを描いています。水素のスペクトルは可視範囲にありますが、特定の元素は紫外または赤外範囲にあるスペクトルを生成します。このため、元素のスペクトルはそのフィンガープリントと見なされます。その独自性に関する知識により、星の組成を研究することができ、科学者が新しい元素を発見するのにも役立っています!
水素のスペクトルを見ると、特定の周波数 (これらの色に関連する周波数) のみが放射されたため、特定の色のみが表示されることが明らかでした。それを考えると、なぜ原子はこの特異な振る舞いを示すのでしょうか?どのような原子構造が、彼ら自身をそれほど簡潔に表現するのにそれほど厳しく制限するのでしょうか? 1913 年、Niels Bohr はついにその理由に気づきました。
ボーアの原子モデル
ボーアは、ラザフォードの太陽系モデルを推し進めましたが、微調整を加えました。彼は、電子が固定または明確な軌道で原子核の周りを回転することを (理由はまだわかっていませんが) 示唆することで、その失敗した側面を修正しました。彼は、これらの軌道では電子がエネルギーを失わないため、原子核に崩壊しないことが保証されると主張しました.
ボーアはこれらの固定軌道を「静止軌道」と呼んだ。彼は、軌道はランダムに配置されているのではなく、中心の核から離散的な距離にあり、それぞれが固定エネルギーに関連付けられていると主張しました.プランクの理論に触発されて、彼は軌道を n、 で表しました。 それを量子と呼んだ 番号.

ボーアの静止軌道。 (写真提供:ブライトレンジ / ウィキメディア コモンズ)
いかに馬鹿げた理論に見えたとしても、それは見事に水素のスペクトルを予言した。それによると、ガスが加熱されると、エネルギーを与えられた電子がエネルギーの低い軌道からエネルギーの高い軌道にジャンプします(水素の場合、n =1 から n =2 へ)。ただし、安定性を取り戻すには、エネルギーの低い軌道に戻る必要があります。この遷移中、電子はそのエネルギーの一部を失う必要があり、光の形で放射されるのはこのエネルギーです!
軌道の離散的な性質は、光子の離散的な性質の簡潔な説明を提供します。ボーアは、放出された光子のエネルギーが、電子がジャンプする 2 つの準位のエネルギーの差に等しいことを発見しました。たとえば、電子が短い飛躍をするときは赤外線が放射され、電子が大きく飛躍するときは紫外線が放射されます。この関係は、E2 – E1 =hv として簡単に表すことができます。 逆に、電子は光子を吸収すると、より高い軌道にジャンプします。
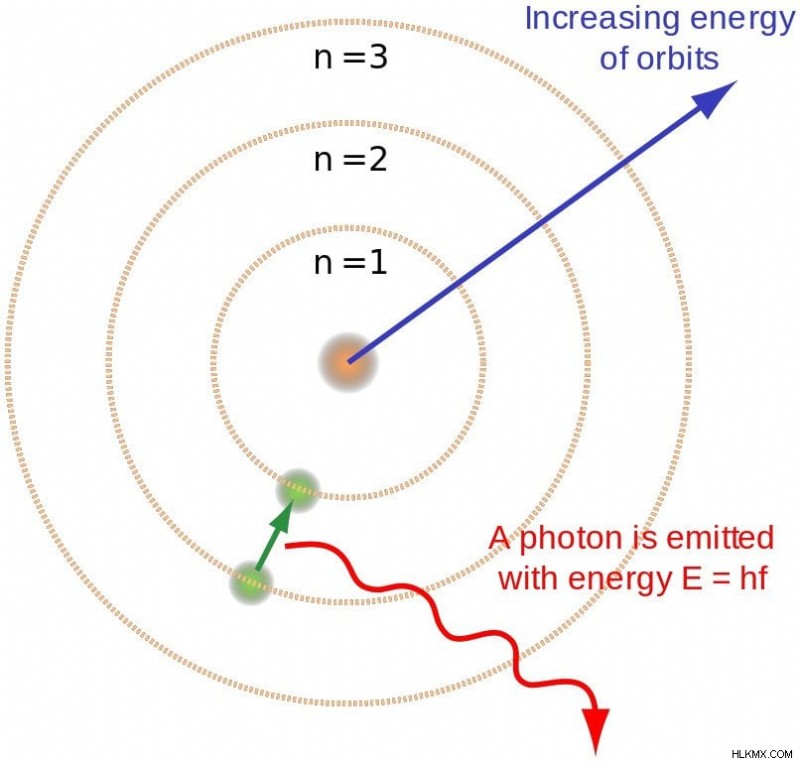
電子が高い軌道から低い軌道に飛び降りるとき、光子が放出されます。 (写真提供:ブライトレンジ / ウィキメディア コモンズ)
原子のスペクトルは特定の色に制限されています。これは、その具体的で組織化された構造により、その電子が特定のエネルギー遷移、つまり特定の光の周波数のみに許可されるためです。では、水素原子に電子が 1 つしか含まれていない場合、そのスペクトルが複数の色で構成されているのはなぜでしょうか?これは、ガスが数百万、数十億の原子で構成されており、電子が近くの軌道よりも高いまたは低い異なる軌道に持ち上げられているためです.
つまり、これはボーアのモデルであり、電子が離散的にエネルギーを与えられた軌道に位置している惑星モデルです。励起された電子が高い軌道から低い軌道に飛び降りるとき、原子は光子を放射します。これらの軌道のエネルギーの差は、光子のエネルギーに等しくなります。
短所
残念ながら、ボーアのモデルは、2 つの荷電点が互いに周回する系の挙動しか説明できませんでした。これは、特に水素原子を意味しました。また、イオン化されたヘリウム (ヘリウムには 2 つの電子があるため、イオン化によってそのうちの 1 つが捕捉され、1 つだけが残ります) または二重イオン化されたリチウム (リチウムには 3 つの電子があります。計算します) も含まれていました。彼の理論では、水素以外の原子の挙動を説明できませんでした.

ボーアのモデルは、2 つの荷電点が互いを周回する系の挙動しか説明できませんでした。これは、特に水素原子を意味していました。
さらに、彼の理論は、電子が糸の上のビーズのように静止軌道に整列することを決定づけ、電子の非相互作用系を仮定していたことを意味します。これは、2つだけでなく、一緒にクラスター化された複数の電子の間の激しく反発する静電気力を恐ろしく割り引きます。最終的に、電子は自転するだけでなく、その軸を中心に自転または自転することを発見しました。ボーアのモデルでは、なぜこれがエネルギー損失につながらなかったのか説明できませんでした。
ボーアの理論がすぐに受け入れられた理由の一部は、観測されていなかった複数のスペクトルの理論的予測に成功したためであると推測されています。それでも、現代の量子力学への道を開くことによって現代物理学に革命をもたらしたとして、広く称賛されています.最終的に、現代の量子力学は、エネルギー殻の真の性質、電子がそれぞれの殻にどのように生息するか、そしてスピンの問題を完全に説明しました.
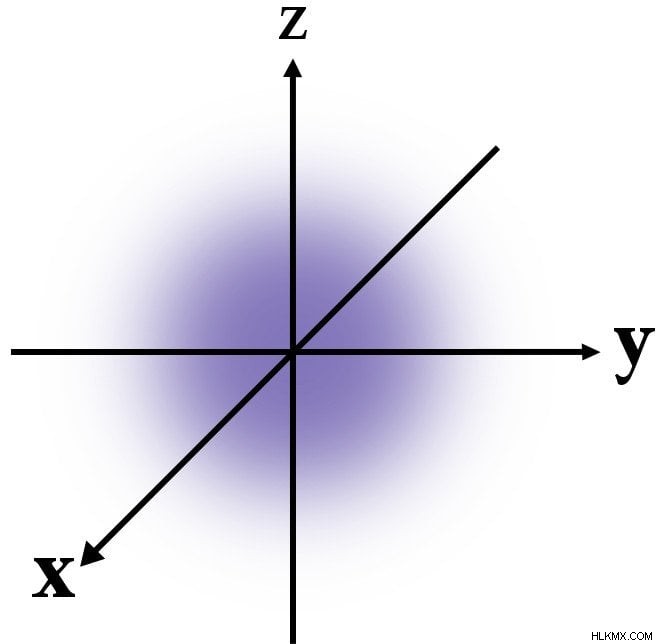
量子力学によれば、エネルギー殻内の電子の正確な位置を決定することはできません。 可能性が高い シェルで見つかります。ここに示されているのは、中心に向かって移動するにつれて青色の密度が徐々に増加する最初のエネルギー シェルです。電子が最も可能性が高いことを示しています 核の近くで見つかります。
しかし、その単純さゆえに、ボーアのアイデアはいまだに存在し続け、高校の物理学を支配しています。教科書には、核を取り囲む電子で満たされた同心円がたくさんあります。これは、糸のビーズモデルに似ています。彼の貢献に対して、ボーアは結局のところ、その無料のビールに値するに違いありません。そしてもちろん…ノーベル賞。







