その理由は次のとおりです。
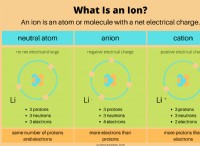
* 電子構成: 炭素の原子番号は6個です。つまり、6個の電子があります。その電子構成は1s²2s²2pp²です。 2Sおよび2p軌道は、基底状態の電子が占める最高のエネルギーレベルです。
* 軌道充填: 電子は、Aufbauの原則とHundのルールに従って軌道を埋めます。 これは、2p軌道よりもエネルギーが高い3D軌道が、炭素の地下状態で空のままであることを意味します。
* ハイブリダイゼーション: 炭素はその基底状態にd軌道を持っていませんが、新しい軌道を形成するためにそのsおよびp軌道を *ハイブリダイズ *する *ことができます。これは、炭素が4つの結合を形成する有機化学に特に関連しています。場合によっては、これらのハイブリッド軌道にはわずかな「D文字」がありますが、これはわずかな貢献であり、実際に炭素がd軌道を持っていることを意味しません。
要約:
*炭素はではありません 基底状態の電子構成にd軌道があります。
*炭素はハイブリッド軌道を形成できますが、これらのハイブリッド軌道には最小限の「D文字」があり、炭素の電子構成にD軌道が含まれないという事実を根本的に変えません。