熱力学の第 2 法則は、自然発生的な過程において、宇宙の全エントロピーは常に増加すると述べています。
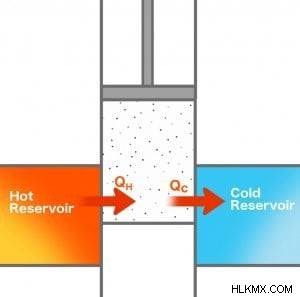
熱機関は 100% の効率で動作できますか? 1824 年、熱力学の父としても知られる科学者ニコラス レオナール サディ カルノーは、その答えを見つけようとしました。彼の理論モデルの 1 つで、彼は 2 つの蓄熱器の間にピストンを備えたシリンダーを配置しました。両方のリザーバーは一定の温度でしたが、一方は他方よりも温度が高かったです。
アイデアは、2 つのリザーバー間の熱流を仕事に変換することでした。それを行うために、彼はリザーバーの間にピストンを備えたシリンダーを配置しました。しかし、彼は 100% の効率を達成することは不可能であることに気付きました。いくらかの熱は常にシリンダーを通って低温リザーバーに流れました.
熱力学の第一法則は、エネルギーは生成も破壊もできないと述べています。形を変えることしかできません。ただし、これには一定の制限があります。変化が起こり得る方向を定義するものではなく、変化が元に戻せるかどうかもわかりません。物体を高いところから落とすと、位置エネルギーが運動エネルギーに変換されて落下します。ただし、地面にぶつかった後、同じ高さに跳ね返ることはありません。なぜそうなのですか?これを理解するために、重要な用語を見てみましょう:自発的なプロセス .
自発的なプロセス
熱力学における自発的なプロセスは、外部からの介入なしに発生するプロセスです。また、発生するのに十分な時間が必要です。コップ一杯の水にインクを一滴入れると、インクは「自然に」グラス全体に広がりますが、スプーン一杯の砂糖はコップ一杯の水に溶けるまでかき混ぜる必要があります。外が暑いとき、部屋は「自然に」暖められますが、部屋を寒く保つにはエアコンが必要です。

インクは水中で自然に広がる
経験から、私たちの人生で起こるいくつかの出来事は自然発生的であることを知っています。しかし、科学者たちは、あらゆる事象の自発性を定義する方法を必要としていました。彼らは、変化が起こる可能性のある方向を定義する方法を必要としていました.この必要性から、熱力学の第 2 法則として知られるものが生まれました。 .
熱力学の第二法則
熱力学の法則は、仕事、熱、およびエネルギーが特定のシステムにどのように影響するかを定義します。システムとは、有限に制限された宇宙の任意の領域であり、エネルギーが伝達されます。この境界の外にあるものはすべて、その周囲と見なされます。
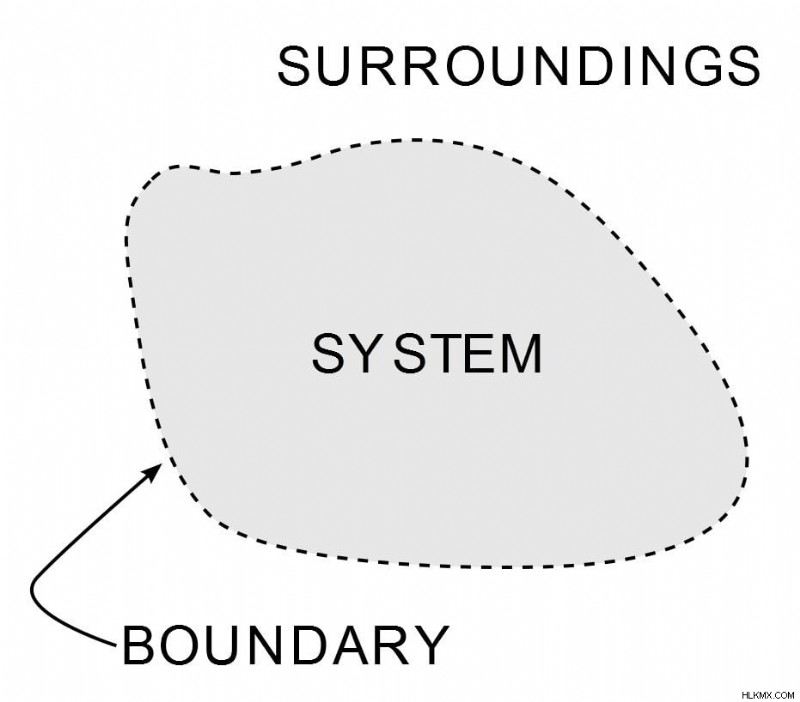
(写真提供:Wavesmikey / ウィキペディア・コモンズ)
熱力学の第 2 法則は、自発的な過程において、宇宙の全エントロピーは常に増加すると述べています。また、式を使用して定義されます:

ここで、S はシステムのエントロピーを表します。この式を理解するために、エントロピー という用語を見てみましょう。
エントロピー
この言葉を聞いたことがあるなら、「障害」を連想するかもしれません。ただし、熱力学では、定義はさらに進化しています。
エントロピーを正しく理解する前に、エネルギーが量子化されていることを理解する必要があります。原子内の電子がエネルギーを受け取るとき、それらは「量子」と呼ばれる少量のエネルギーの整数倍でのみそれを吸収します。
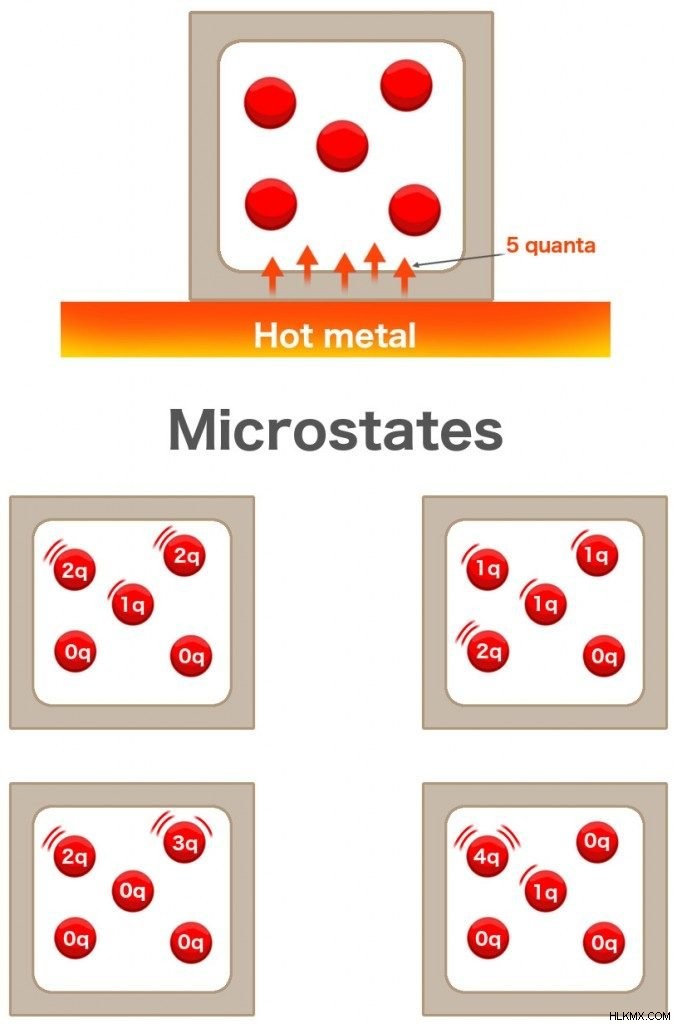
コップ一杯の水にインクを一滴入れると、水全体にインクが広がります。同様に、テーブルの上に熱い金属を置いておくと、そこからの熱が環境全体に広がります。 5 分子の気体が入った箱があるとします。この溶銑のすぐそばに保管されています。金属は 5 量子の熱をガスに伝達します。ガスの各分子は、それぞれ 1 量子のエネルギーを取得しますか?必ずしもそうではありません。

2 つの分子がそれぞれ 2 つの量子を取得し、1 つの分子が 1 つの量子を取得し、他の 2 つのユニットは何も取得しない可能性があります。 1 つの分子が 3 量子を取得し、別の分子が 2 を取得し、他の分子がまったく取得しない可能性もあります。 126 通りの組み合わせが可能で、次の式を使用して計算できます:
 ここで、N は分子の数、q は供給されるエネルギーの量です。
ここで、N は分子の数、q は供給されるエネルギーの量です。
これらの分子は互いにぶつかり合い、運動エネルギーを交換することもできます。ただし、総エネルギーが提供されるエネルギー量を超えることはできません。
これらの組み合わせはそれぞれ「マイクロステート」と呼ばれます。 総エネルギー レベルは「マクロステート」と呼ばれます。 エントロピーは、エネルギーがすべての分子に分配される方法の数の尺度です。したがって、これは「マイクロステート」の数の要素です 」、また Ω として表されます。
エントロピーは状態変数です。状態変数は、圧力、温度、体積など、システムの物理的な状態を表す変数です。エントロピーの数式は次のとおりです:
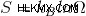
ここで、kB はボルツマン定数です。温度に対する気体中の粒子の平均運動エネルギーを表す物理定数です。この定数は、エントロピーを計算するためにマイクロステート数の自然対数に乗算されます。
エントロピーの変化は、吸収された熱を温度で割ることによって計算することもできます。吸収された熱は、粒子の運動エネルギーを増加させます。したがって、式は次のとおりです。
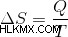
簡単に言えば、エントロピーは、システム内の一連の分子にエネルギーを分配できる方法の数の尺度です。
熱機関のエントロピーの計算
カルノーのエンジンに戻って、いつ熱エンジンが可能になるかを考えてみましょう。高温の貯留層の温度が TH で、低温の貯留層の温度が TC であると仮定しましょう。 QH 量の熱がホット リザーバーから取り出され、何らかの作業が行われます。
したがって、高温貯留層のエントロピーの変化は次のとおりです。
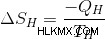
貯留層から熱が抽出されるため、Q は負です
エンジンのピストンが仕事をして初期状態に戻ると、エンジンのエントロピーの変化 ( 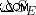 ) は 0 です。
) は 0 です。
仕事をするためにすべてのエネルギーが使い果たされ、冷たい貯留層に熱が与えられないと仮定すると、冷たい貯留層のエントロピー (  ) も 0 です。
) も 0 です。
そう、 
ここで、コールド リザーバーが QC 量の熱を吸収し、何の作業にも使用されないと仮定しましょう。その場合、コールド リザーバーのエントロピー (  ) は
) は 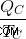
その場合、 
エンジンが動作できる唯一のケースは、 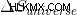 が正または
が正または 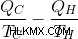 は、熱力学の第 2 法則が示すように正です。
は、熱力学の第 2 法則が示すように正です。
19 世紀後半、ケルビン卿とマックス プランクはこれらの観察を行いました。彼らは次のように述べています。このステートメントは、熱力学の第 2 法則の代替ステートメントでもあります。
普遍的な法則
アルバート アインシュタインは、熱力学の複雑な言語に堪能でした。実際、彼はこのテーマについていくつかの論文を発表しました。彼はかつて次のように引用しました。したがって、古典熱力学が私に与えた深い印象。それは、その基本概念の適用可能性の枠組みの中で、決して覆されることはないと私が確信している普遍的な内容の唯一の物理理論です。」
熱力学第二法則が宇宙を動かす。私たちは宇宙が膨張していることを知っています。熱力学の第 2 法則に従って、宇宙のエントロピーも増加する必要があります。星は宇宙のエネルギー源です。最後の星が最後の光子を放出する頃には、エントロピーのレベルは信じられないほど高くなります。心配しないでください…私たちは皆、この時よりずっと前に死んでいたでしょう。それは、宇宙のエントロピーを増加させるエネルギーが残っていないため、宇宙が死ぬときです!
続きを読む:
熱力学の第一法則とは?
熱力学の第三法則とは?







