Iso は定数の略で、thermal は温度の略です。等温プロセスは、温度が一定であるプロセスです。圧縮は、システムの体積が減少するか、圧力が増加するプロセスです。等温圧縮は、温度が一定の圧縮プロセスです。これは、閉じたシステムで発生する熱力学的プロセスです。このプロセスは熱平衡を維持します。
熱平衡とは?
熱平衡は、温度がシステム全体で一定の状態です。 2 つの物体は、温度が同じ場合、熱平衡状態にあると言われます。
たとえば、オブジェクト A と B の温度は摂氏 20 度で均一です。オブジェクトは熱平衡状態にあると言われています。同様に、摂氏 20 度の均一な温度を持つシステムも熱平衡状態にあります。
理想気体の方程式
理想気体は、互いに反発し合う粒子または分子からなる理論上の気体です。理想気体分子は、与えられた空間全体で膨張できます。分子または粒子の体積はゼロと見なされます。理想気体は、次のように表すことができる理想気体方程式に従います。
PV =nRT
ここで、P は気体の圧力、V は気体の体積、n はモル数、R は普遍気体定数、T は気体の温度です。
理想気体の等温圧縮の方程式
前述のように、理想気体は式 PV =nRT に従います。ここで、等温圧縮プロセスでは、システムの温度は一定です。閉じたシステムを仮定すると、モル数 n も一定になります。
したがって、等温圧縮の方程式は次のように記述できます
PV =C
C は定数です。
上記の式は次のようにも記述できます
T =定数
T =0
等温圧縮下のシステムを想定します。初期状態を 1、最終状態を 2 とします。
この系の方程式は次のように書ける
P1V1=P2V2=定数
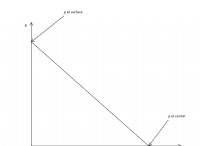
等温圧縮プロセスのグラフ
状態 1 と状態 2 の間の等温圧縮プロセスの P-V 曲線は次のように表すことができます:

上記の曲線から次のことがわかります:
<オール>等温過程で行われる仕事
等温プロセスによって行われる仕事は、dW の積分です。ここで、dW は変位仕事または PdV です。
この過程で、気体はボイルの法則 (理想気体) に従い、気体が行う仕事は
W =nRT ln (Vf / Vi)
ここで、Vf
これは、気体の体積が Vi から Vf に変化したときに伝達される熱量でもあります。温度差がゼロであるため、このようなプロセスにおけるシステムのモル熱容量は無限大です。
温度差が一定またはゼロの圧縮は、等温圧縮プロセスです。システムが一定の温度を維持するのに時間がかかるため、これらのプロセスは非常に遅くなります。たとえば、水で満たされた瓶をスライド式のふたで加熱します。理想的な等温圧縮プロセスを達成することは不可能であるため、ここでは損失は無視されます。
等温圧縮プロセスの圧力体積曲線は次のように表すことができます
上記の 2 つの曲線は、温度が一定で、圧力が増加するか、体積が減少する等温プロセスを表します。システムは圧縮プロセスのために動作する必要があるため、ここでは実行された作業は負であると見なされます。システムによって行われる作業は慣例であるため正の量であり、その逆も同様です。
等温圧縮は、システムの温度が一定の場合に、体積を減少させるか圧力を増加させる熱力学的プロセスです。このプロセスは、熱平衡の状態を維持します。熱力学系、熱力学プロセスの種類、等温圧縮プロセスの詳細について学びました。等温圧縮プロセスで行われる仕事についても説明しますが、これは外部から供給される負の仕事です。等温圧縮の例

結論