主な違い – 還元剤と酸化剤
還元剤と酸化剤は、酸化還元反応に関与する化合物です。これらの化合物は、酸化還元反応の反応物です。還元剤と酸化剤の主な違いは、還元剤は電子を失って酸化されるのに対し、酸化剤は電子を獲得して還元されることです。
対象となる主な分野
1.還元剤とは
– 定義、特性、反応メカニズム、例
2.酸化剤とは
– 定義、特性、反応機構、例
3.還元剤と酸化剤の違いは何ですか
– 主な違いの比較
キーワード:半反応、酸化、酸化状態、酸化剤、レドックス反応、還元剤、還元 
還元剤とは
還元剤は、電子の一部を失うことによって酸化できる物質です。原子の電荷は電子の負電荷による核の正電荷のバランスに依存しているため、電子の損失により還元剤は正電荷を取得します。したがって、電子を失った後は、対応する原子核の正電荷と釣り合うのに十分な負電荷がありません。したがって、プラスの電荷が残ります。この電荷は、原子の酸化状態と呼ばれます。
還元剤は、同じ元素または異なる元素を含む物質です。還元剤であるためには、複数の元素で構成される化合物は、可能な限り低い酸化状態にある元素を少なくとも 1 つ持っている必要があります。これにより、この元素はより高い酸化状態に酸化され、その電子を失います。たとえば、SO3 還元剤として働くことができます。硫黄原子は+4の酸化状態にあります。硫黄が保持できる最大の酸化数は +6 です。したがって、+4 状態の硫黄は +6 酸化状態に酸化できます。
レドックス反応では、全体の反応はその系で起こる半反応から得られます。 2つの半反応は、酸化反応と還元反応です。酸化反応は常に還元剤の酸化を表します。
有機化学では、Red-Al または還元アルミニウム化合物が一般的に使用される還元剤です。次の画像は、この化合物によって還元される官能基を示しています。
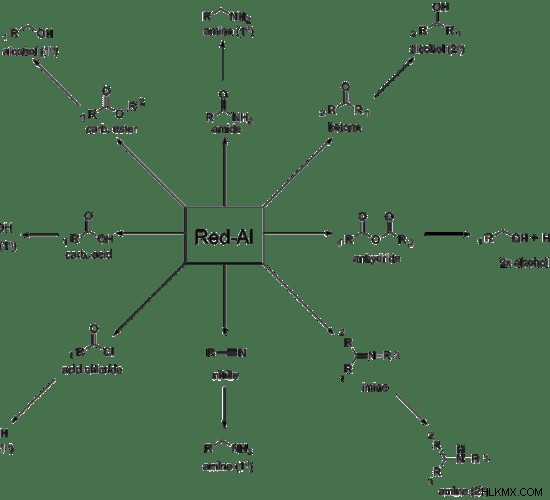
図 1:Red-Al の反応
還元剤の酸化反応
以下は、還元剤が受ける反応の種類です。
ゼロ酸化状態から正酸化状態への酸化
リチウム (Li) は強力な還元剤です。電子をすぐに失って +1 の酸化状態になるからです。半分の反応は、
Li → Li + e
正の酸化状態からより高い正の酸化状態への酸化
H2 C2 O4 も良い還元剤です。 C原子の酸化状態は+3です。 C原子が持つことができる最高の酸化状態は+4です。したがって、CO2 に酸化することができます .半分の反応は、
H2 C2 O4 → 2CO2 + 2H + 2e
負の酸化状態からゼロ酸化状態への酸化
O2 酸化物中のOから作ることができます。たとえば、Ag2 O は Ag と O2 に酸化できます .
2Ag2 O → 4Ag + O2
負の酸化状態から正の酸化状態への酸化
H2 の酸化 S を H2 に SO4 硫黄の酸化数が -2 から +6 に変化します。
S + 4H2 O → SO4 + 8H + 8e
酸化剤とは
酸化剤とは、電子を得ることで還元できる物質です。したがって、酸化還元反応における電子受容体または受容体と呼ばれます。還元の半反応は、酸化剤が受ける反応です。外部から電子を得ると、原子核で中和しきれない負電荷が多くなります。したがって、原子は負の電荷を取得します。しかし、この還元が正に帯電した原子で起こる場合、より低い正電荷または中性電荷を得ることができます.
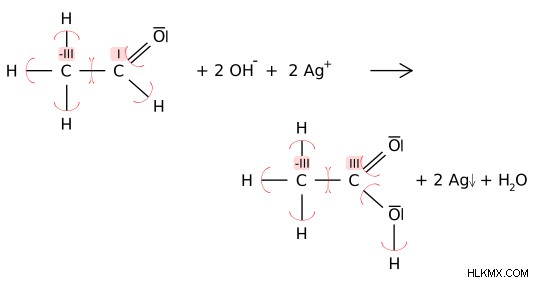
図 2:還元剤 C2H4O は、Ag+ を Ag に還元します。そこでは、アルデヒド炭素 (I) の酸化数が、カルボキシル炭素原子で (III) に酸化されます。
酸化剤では、還元によって原子の酸化状態が低下します。たとえば、正電荷を持つ原子 (Na など) がある場合、それを還元して酸化状態をゼロにすることができます (ナイント Na)。同様に、電荷がゼロの原子または分子 (O2 など) ) を負電荷 (O2 2O に)
酸化剤の還元反応
酸化剤の還元は、主に次の方法で起こります。
ゼロ酸化状態から負酸化状態への還元
酸素 (O2 ) とオゾン (O3 ) は酸化剤として作用します。それらは O に還元されます。この還元された形は、H2 の O など、さまざまな形に含めることができます。 OとCO2 .
O2 + 4H + 4e → 2H2 O
正の酸化からより低い正の酸化状態への還元
MnO4 のマンガン (Mn) MnまたはMnO2に還元できます (Mn).
MnO4 + 8H + 5e→ Mn + 4H2 O
正の酸化状態からゼロ酸化状態への還元
HF (F の -1 酸化状態) は F2 に還元できます (Fの酸化状態ゼロ)
2 HF → F2 + H2
2F → F2 + 2e
正の酸化状態から負の酸化状態への還元
SO4 中の硫黄 (+6 酸化状態) は H2 に還元できます S (-2 酸化状態).
SO4 + 8H + 8e → S + 4H2 O
還元剤と酸化剤の違い
定義
還元剤: 還元剤は、電子の一部を失うことによって酸化できる物質です。
酸化剤: 酸化剤とは、電子を得ることで還元できる物質です。
酸化状態
還元剤: 還元剤の酸化状態が増加します。
酸化剤: 酸化剤の酸化状態が低下します。
電子交換
還元剤: 還元剤は電子供与体として機能します。
酸化剤: 酸化剤は電子受容体として機能します。
エージェントの酸化状態の変化
還元剤: 還元剤は反応中に酸化されます。
酸化剤: 酸化剤は反応中に還元されます。
他の反応物の酸化状態の変化
還元剤: 還元剤は別の反応物の還元を引き起こします。
酸化剤: 酸化剤は、別の反応物の酸化を引き起こします。
結論
還元剤と酸化剤は、酸化還元反応に関与する化合物です。還元剤と酸化剤の主な違いは、還元剤は電子を失って酸化されるのに対し、酸化剤は電子を獲得して還元されることです。







