電解質 水に溶けるとイオンになる(イオン化する)化学物質です。正に帯電したイオンは陽イオンと呼ばれ、負に帯電したイオンは陰イオンと呼ばれます。物質は、強電解質、弱電解質、または非電解質に分類されます。
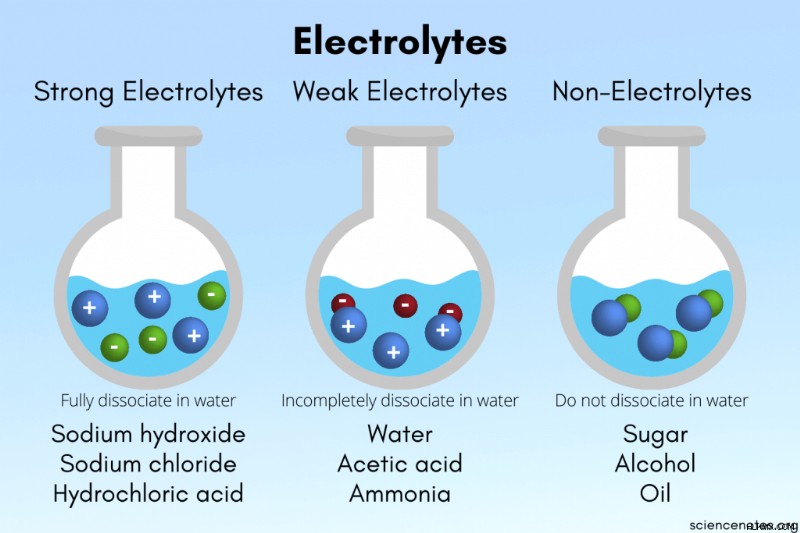
強力な電解質
強力な電解質は水中で完全にイオン化します。これは、溶解した化学物質の 100% が陽イオンと陰イオンに分解されることを意味します。ただし、完全に水に溶けるわけではありません!たとえば、一部の種は水にほとんど溶けませんが、強力な電解質です。これは、ほとんど溶解しないことを意味しますが、溶解したものはすべてイオンに分解されます。例として、強塩基水酸化ストロンチウム Sr(OH)2 があります。 .水への溶解度は低いですが、Sr イオンと OH イオンに完全に解離します。水中の水酸化ナトリウム(NaOH)のフラスコには水中の Na イオンと OH イオンが含まれますが、実際の NaOH は含まれませんが、水酸化ストロンチウム水溶液のフラスコには Sr イオンと OH イオン、Sr(OH)2 が含まれます。 、および水。
例 :強酸、強塩基、および塩は強電解質です。
弱電解質
弱電解質は水中で部分的にイオン化します。 0% から 100% の間のイオンへの解離のほとんどは、化学物質を弱電解質にしますが、実際には弱電解質の約 1% から 10% がイオンに分解します。
例 :弱酸と弱塩基は弱電解質です。ほとんどの窒素含有分子は弱電解質です。水は部分的に H イオンと OH イオンに解離するため、一部のソースでは弱電解質と見なされますが、イオンに解離する水は非常に少量であるため、他のソースでは非電解質と見なされます。
非電解質
物質が水中でまったくイオン化しない場合、それは非電解質です。
例 :ほとんどの炭素化合物は非電解質です。脂肪、糖、およびアルコールは、ほとんどが非電解質です。
なぜ気にする必要があるのですか?
化学物質が電解質であるかどうか、および水中でどれくらい強く解離するかを知る最も重要な理由は、水中で起こり得る化学反応を決定するためにこの情報が必要だからです.また、化学物質が水に入っている容器がある場合は、その物質が水に溶けるかどうか (溶解度) と、イオンに解離するかどうかを知ることをお勧めします。
これが重要な理由の典型的な例は、シアン化ナトリウム (NaCN) 溶液です。シアン化物が反応性があり、非常に有毒であることはおそらくご存知でしょう。では、水に溶かしたシアン化ナトリウムのボトルを開けますか?シアン化ナトリウムが塩であることを認識していれば、水にはシアン化ナトリウムがなく、Na イオンと CN イオンだけであるため、(溶液を飲まなければ) 安全であることがわかります。シアン化物イオンは揮発性がなく、病気になりません。これをシアン化水素 (HCN) のボトルと対比してください。そのボトルを開けてくれませんか?シアン化水素が弱酸であることを認識していれば、ボトルにはシアン化水素ガス、水素イオン、シアン化物イオン、および水が含まれていることがわかります.そのボトルを開けると、あなたの命が危険にさらされる可能性があります!
どの化学物質が電解質かをどのように知っていますか?
電解質が何であるかを知りたいと思ったので、名前や構造に基づいて化学物質がどのタイプの電解質であるかを知る方法を知りたいと思うでしょう.これを消去法で行います。強電解質、弱電解質、および非電解質を特定するための手順を次に示します。
<オール>強電解質、弱電解質、非電解質の表
この表は、強電解質、弱電解質、および非電解質のグループと、各カテゴリの例をまとめたものです。
| 強電解質 | |
| 強酸 | HCl (塩酸) |
| HBr (臭化水素酸) | |
| HI (ヨウ化水素酸) | |
| HNO3 (硝酸) | |
| HClO3 | |
| HClO4 | |
| H2 SO4 (硫酸) | |
| 強塩基 | NaOH (水酸化ナトリウム) |
| KOH (水酸化カリウム) | |
| LiOH | |
| Ba(OH)2 | |
| Ca(OH)2 | |
| 塩 | NaCl |
| KBr | |
| MgCl2 | |
| 弱電解質 | |
| 弱酸 | HF (フッ化水素酸) |
| HC2 H3 O2 (酢酸) | |
| H2 CO3 (炭酸) | |
| H3 PO4 (リン酸) | |
| 弱塩基 | NH3 (アンモニア) |
| (「N」化合物) | C5 H5 N (ピリジン) |
| 非電解質 | |
| 砂糖と炭水化物 | C6 H12 O6 (ブドウ糖) |
| 脂肪と脂質 | コレステロール |
| アルコール | C2 H5 OH(エチルアルコール) |
| その他の炭素化合物 | C5 H12 (ペンタン) |