化学式 化学反応を象徴的に表現したもので、反応における反応物と生成物、および反応が進行する方向を示します。フランスの化学者ジャン ベガンは、1615 年に最初の化学式を定式化した功績を認められています。
ここでは、化学式の種類、含まれる部分、および例について説明します。
化学式の一部
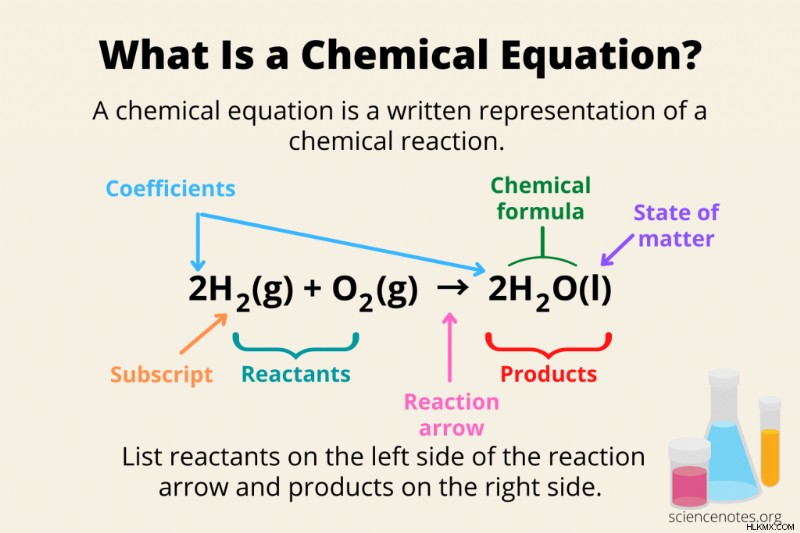
化学方程式の 3 つの重要な部分は、反応物、生成物、および反応矢印ですが、多くの方程式にはさらに多くの情報が含まれています。
- 化学式 :反応物と生成物は、元素記号と添字を使用して化学式として記述されます。
- 反応物 :慣例により、化学反応は左から右に読み取られます。反応物は式の左側に書かれています。反応物の化学構造を描くことは問題ありませんが、通常の方法では反応物の化学式が得られます (例:H2 、O2 ).
- 製品 :化学反応の生成物は、反応矢印の右側に書かれています。
- リアクションアロー :反応の矢印は、化学反応が進行する方向を示します。
- プラス記号 :複数の反応物または生成物が発生する場合は、それらの間にプラス記号 (+) を使用します。
- 係数 :係数は化学式の前に書かれた数字です。それらは反応物と生成物の化学量論を示しているため、バランスのとれた式でそれらの間のモル比が一目でわかります。たとえば、式 4H2 では O2 、「4」は係数です。慣例により、数字の「1」は省略されます。つまり、O2 と書きます。 1O2 ではありません .通常、係数は整数ですが、分数や小数点を使用した方程式が表示されることがあります。
- 下付き文字 :化学式の元素記号の後に下付き文字が続き、化合物にその元素の原子がいくつあるかを示します。たとえば、H2 の「2」 O は添え字です。
- 状態 :すべての化学式が反応物と生成物の状態を示しているわけではありません。しかし、指定された場合、物質の状態は、括弧で囲まれた反応物または生成物の化学式に従います。物質の状態の略語は、(s) は固体、(l) は液体、(g) は気体、(aq) は種が水溶液に溶解している場合です。
化学式の反応矢印
反応矢印のタイプは、化学反応が進行する方向を表します:
- 最も一般的な反応の矢印は左から右を指します。記号 → は、反応物が反応して生成物を生成する正味順方向に反応が進行することを意味します。
- いくつかの方程式は平衡を示しています。記号 ⇌ は、反応物と生成物との間の化学平衡状態を示します。反応は両方向に進行し、式の両側が反応物と生成物として同時に作用します。一方の矢印が他方より短い場合、長い矢印は反応が進行する主な方向を表し、短い矢印は反応がこの方向でまだ発生するが、優先されないことを示します。
- 記号 ⇄ は、反応が順方向と逆方向の両方に進行することを意味します。
- 等号または =は化学量論的関係を示します。
不均衡および平衡化学式
化学式は、不均衡または均衡のいずれかです。
- 不均衡な化学式は、反応物と生成物、および反応の進行方向をリストしますが、反応物と生成物のモル比は指定しません。
例:H2 + O2 → H2 〇
- バランスのとれた化学式は、化学式の前に係数を含み、反応物と生成物の化学量論比を示します。バランスの取れた化学式では、反応矢印の両側に等しい数と種類の原子が含まれます。質量と電荷のバランスがとれています。
例:2H2 + O2 → 2H2 ああ
イオン化学式
イオン化学方程式は、反応物と生成物の正味の電荷を示します。平衡イオン方程式では、正味の電荷は反応矢印の両側で同じです。
例:2Ag(aq) + Cr2 O7 (aq) → Ag2 Cr2 O7 (秒)
係数に電荷を掛けることに注意してください。この例では、銀イオンに 2 つの「+」電荷、クロム酸イオンに 2 つの「-」電荷があります。これらの電荷は互いに打ち消し合い、式 [2(+1) + 1(−2) =0] の反応物側に正味の中性電荷が残ります。製品であるクロム酸銀は電気的に中性です。
参考文献
- ブレイディ、ジェームズ E.; Senese、フレデリック。 Jespersen、ニール D. (2007)。 化学:物質とその変化 .ジョン・ワイリー&サンズ. ISBN 9780470120941.
- IUPAC (1997)。 「化学反応式」 化学用語集 (第2版)(「ゴールドブック」)。オックスフォード:Blackwell Scientific Publications。 ISBN 0-9678550-9-8。 doi:10.1351/goldbook
- マーシャル、ヒュー (1902)。 「化学表記法で使用するための等号の修正案」。 エジンバラ王立協会の議事録 . 24:85–87. doi:10.1017/S0370164600007720
- マイヤーズ、リチャード (2009)。 化学の基礎 .グリーンウッド出版グループ. ISBN 978-0-313-31664-7.
- van 't Hoff, J.H. (1884)。 エチュード ドゥ ダイナミック ケミーク [ケミカルダイナミクスの研究] (フランス語).アムステルダム、オランダ:Frederik Muller &Co.