定義上、イオン化エネルギー は、気体原子またはイオンから最も緩く結合した電子を除去するために必要な最小エネルギーです。この用語は、ionisation energy (英国英語) とも綴られています。イオン化エネルギーは記号 IE、IP、ΔH° で表され、単位はキロジュール/モル ((kJ/mol) または電子ボルト (eV) です。
イオン化エネルギーは、原子またはイオンから電子を取り除くのに必要なエネルギーです。
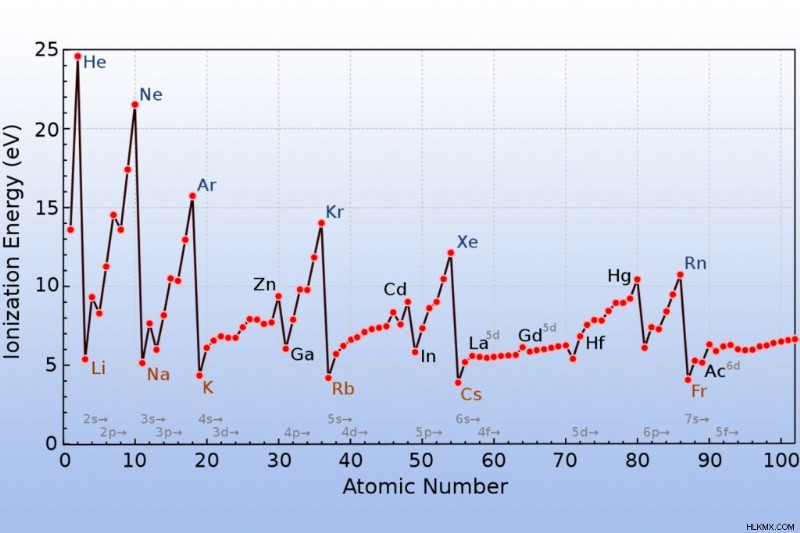
イオン化エネルギーは、期間を移動すると増加し、グループを下に移動すると減少します。この周期表の傾向には例外があります。
フランシウム (アルカリ金属) はイオン化エネルギーが最も低く、ヘリウム (希ガス) はイオン化エネルギーが最も高くなります。
最初のイオン化エネルギーは最も低いです。後続の各電子を除去するには、より多くのエネルギーが必要です。
イオン化エネルギーの重要性
イオン化エネルギーは、原子から電子を除去することがどれほど難しいかを反映するため、原子が形成する化学結合の反応性と強度を予測するのに役立ちます。イオン化エネルギーが高いほど、電子を取り除くのが難しくなります。そのため、イオン化エネルギーの低い原子 (アルカリ金属など) は反応性が高く、化学結合を容易に形成する傾向があります。イオン化エネルギーの高い原子 (希ガスなど) は反応性が低く、化学結合や化合物を形成する可能性が低くなります。
周期表におけるイオン化エネルギーの傾向
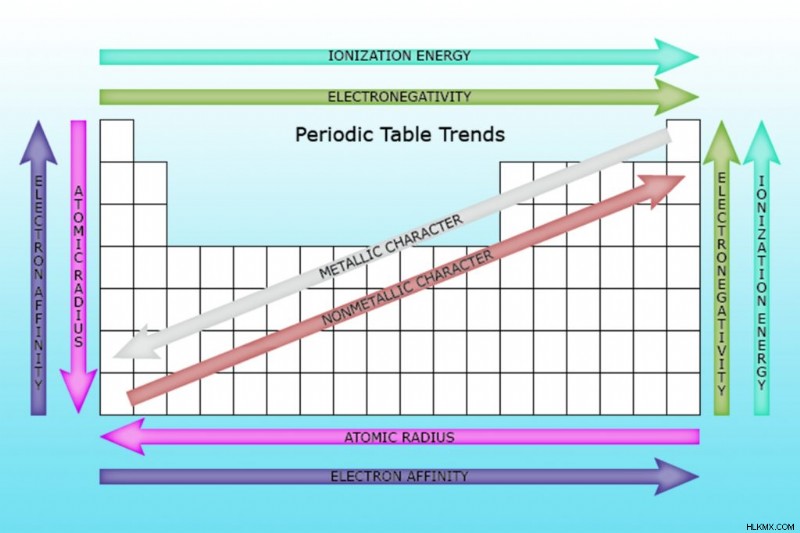
イオン化エネルギーが最も高い元素はヘリウムで、周期表の右上に位置し、希ガスの 1 つです。表の左下に位置するアルカリ金属であるフランシウムは、最も低いイオン化エネルギーの 1 つです。イオン化エネルギーは、周期表の傾向を示します。
- 一般に、イオン化エネルギーは、要素周期 (行) を横切って左から右に移動して増加します。その理由は、原子半径が周期を超えて減少する傾向があるためです。これは、より多くの陽子が追加され、原子核と電子の間の引力が増加し、電子殻がより近くに引き寄せられるために発生します。
- 一般に、イオン化エネルギーは元素グループ (列) の上から下に向かって減少します。その理由は、最も外側の (価電子) 電子の主量子数が下に行くほど増加するためです。原子にはグループを下って移動するより多くの陽子があり、電子殻を引き込みます。ただし、各行は新しい殻を追加するため、最も外側の電子は原子核からさらに離れています.
トレンドの例外
イオン化エネルギーの傾向にはいくつかの例外があります。例えば、ホウ素の第一イオン化エネルギーは、ベリリウムの第一イオン化エネルギーよりも低い。酸素のイオン化エネルギーは窒素のイオン化エネルギーよりも低いです。フントの法則と原子の電子配置が原因で、例外が発生します。基本的に、完全なサブレベルは、半分満たされたサブレベルよりも安定しているため、中性原子は自然にこの構成に移動します。また、サブ準位に反対のスピン値を持つ 2 つの電子があるかどうかも重要です。
ベリリウムの場合、最初のイオン化ポテンシャル電子は 2 から発生します。 ただし、ホウ素のイオン化には 2p が含まれます。 電子。窒素と酸素の両方について、電子は 2p から来ます。 軌道ですが、スピンはすべての 2p で同じです 窒素電子、一方 2p の 1 つに電子対のセットがあります。 酸素軌道。
第一、第二、第三のイオン化エネルギー
最初のイオン化エネルギーは、外側の価電子を取り除くために必要なエネルギーであるため、最も低い値です。一般に、2 番目のイオン化エネルギーは 1 番目よりも高く、3 番目は 2 番目よりも高くなります。後続の電子を除去することは、最初の電子を除去することよりも困難です。これらの電子は原子核により強く結合しており、原子核により近い可能性があるためです。
たとえば、最初の (I1 ) と秒 (I2 ) マグネシウのイオン化エネルギー:
Mg (g) → Mg (g) + e I1 =738 kJ/モル
Mg (g) → Mg (g) + e I2 =1451 kJ/mol
電子親和力の傾向
電子親和力は、中性原子がどれだけ容易に電子を獲得して負イオンを形成できるかの尺度です。電子親和力とイオン化エネルギーは、周期表で同じ傾向に従います。電子親和力は、期間を移動すると増加し、グループを下に移動すると減少します。
参考文献
- コットン、F. アルバート。ウィルキンソン、ジェフリー (1988)。 高度な無機化学 (第5版)。ジョン・ワイリー。 ISBN 0-471-84997-9.
- ラング、ピーター F.;スミス、バリー C. (2003)。 「原子と原子イオンのイオン化エネルギー」。 J.化学。教育 . 80 (8). doi:10.1021/ed080p938
- マイスラー、ゲーリー L.;ター、ドナルド A. (1999)。 無機化学 (第 2 版)。プレンティス・ホール。 ISBN 0-13-841