主な違い - アルカリ金属とアルカリ土類金属
地球上のすべての元素は、金属、非金属、半金属、不活性ガスに分類できます。不活性ガスは、安定した最外オクテットが存在するため、反応性がゼロの元素です。半金属は、金属と非金属の両方の特定の特性を持つ要素です。非金属は、金属の性質を持たない元素です。金属は、優れた電気伝導性や熱伝導性、光沢など、いくつかの固有の特性を持つ要素です。金属は、周期表の左側と中央に配置されます。周期表のすべての金属は、3 つのグループに分類されます。アルカリ金属、アルカリ土類金属、遷移金属。アルカリ金属とアルカリ土類金属の主な違いは、アルカリ金属は最外軌道に 1 つの価電子を持つことです。 アルカリ土類金属は、最も外側の軌道に 2 つの価電子を持っています。
この記事では、
1.アルカリ金属とは
– 定義、特性、プロパティ、例
2.アルカリ土類金属とは
– 定義、特性、プロパティ、例
3.アルカリ金属とアルカリ土類金属の違いは何ですか

アルカリ金属とは
アルカリ金属は、最外殻に価電子を 1 つだけ持つ元素です。これらの金属は、周期表のグループ IA に配置されます。これらの金属には、リチウム、ナトリウム、カリウム、ルビジウム、セシウム、およびフランシウムが含まれます。最外殻の単一電子を電子受容原子に供与することにより、これらの金属は正に帯電し、希ガスの電子配置を取得します。すべてのアルカリ金属はイオン性であり、電子価を示します。正に帯電した核は、より多くの電子で満たされた内殻が存在するため、最も外側の電子に向かって引力が少なくなるため、電子供与傾向はグループの下に向かって増加します。他のほとんどの金属とは異なり、アルカリ金属は密度が低く、融点が低く柔らかいです。これらの金属は、周期表のすべての金属の中で最も反応性が高いです。
アルカリ土類金属とは
アルカリ土類金属は、最外殻に 2 つの価電子を持つ金属です。ベリリウム、マグネシウム、カルシウム、ストロンチウム、バリウム、ラジウムを含む6つのアルカリ土類金属があります。それらは、最も外側の電子の供与を通じて希ガスの電子配置を獲得することによって安定します。電子が電気陰性原子に与えられると、アルカリ土類金属は正に帯電します。アルカリ土類金属は反応性の高い金属で、周期表の 2 列目に配置されています。これらの金属は、世界中のあらゆるものの構成要素です。これらの金属は、自然界では硫酸塩の形で見つかることがよくあります。例には、石膏などのミネラルが含まれます。硫酸カルシウム、エプソマイト;硫酸マグネシウムおよび重晶石;硫酸バリウム
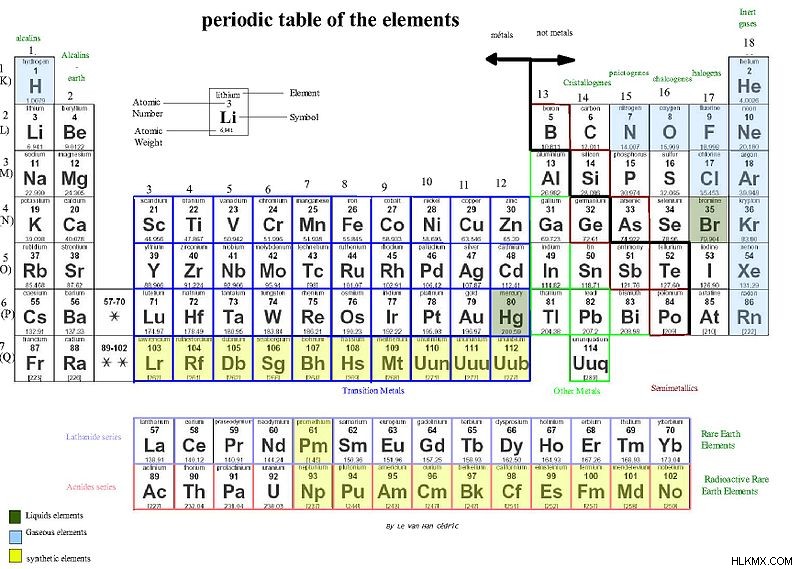
図 1:アルカリおよびアルカリ土類金属を示す周期表
アルカリ金属とアルカリ土類金属の違い
原子の最外殻の電子数
アルカリ金属: 各アルカリ金属は 1 つの電子を持っています。
アルカリ土類金属: 各アルカリ土類金属には 2 つの電子があります。
金属の性質
アルカリ金属: アルカリ金属は柔らかい。
アルカリ土類金属: アルカリ土類金属は硬いです。
融点
アルカリ金属: アルカリ金属は融点が低い。
アルカリ土類金属: アルカリ金属は比較的高い融点を持っています.
金属水酸化物の性質
アルカリ金属: アルカリ金属の水酸化物は強塩基性です。
アルカリ土類金属: アルカリ土類金属の水酸化物は、比較的塩基性が低くなります。
炭酸塩の分解
アルカリ金属: アルカリ金属の炭酸塩は分解しません。
アルカリ土類金属: アルカリ土類金属の炭酸塩は、高温に加熱すると分解して酸化物を形成します。
硝酸塩の加熱
アルカリ金属: アルカリ金属の硝酸塩は、対応する硝酸塩と酸素を生成物として与えます。
アルカリ土類金属: アルカリ土類金属の硝酸塩は、対応する酸化物、二酸化窒素、酸素を生成物として与えます。
加熱時の水酸化物の安定性
アルカリ金属: アルカリ金属の水酸化物は安定です。
アルカリ土類金属: アルカリ土類金属の水酸化物は酸化物を形成します。
室温での重炭酸塩の性質
アルカリ金属: アルカリ金属の炭酸水素塩は固体で存在します。
アルカリ土類金属: アルカリ土類金属の重炭酸塩は溶液の形で存在します。
加熱による過酸化物の形成
アルカリ金属: アルカリ金属は加熱すると過酸化物を形成します。
アルカリ土類金属: バリウム以外のアルカリ土類金属は過酸化物を形成しません。
窒化物の形成
アルカリ金属: アルカリ金属は、リチウムを除いて窒化物を形成しません。
アルカリ土類金属: アルカリ土類金属は安定した窒化物を形成します。
炭化物の形成
アルカリ金属: リチウム以外のアルカリ金属は炭化物を形成しません。
アルカリ土類金属: アルカリ土類金属は安定した炭化物を形成します。
例
アルカリ金属: リチウム、ナトリウム、カリウム、ルビジウム、セシウム、フランシウムはアルカリ法の例です。
アルカリ土類金属: ベリリウム、マグネシウム、カルシウム、ストロンチウム、バリウム、ラジウムはアルカリ土類金属の例です。
まとめ
アルカリ金属とアルカリ土類金属は、原子の最外殻にそれぞれ一価電子と二重価電子を含む重要な元素です。アルカリ金属とアルカリ土類金属の主な違いは、原子の最外殻にある電子の数と、周期表での位置です。アルカリ金属 (リチウム、ナトリウム、カリウム、ルビジウム、セシウム、フランシウム) は最初の列 (IA) に配置され、アルカリ土類金属 (ベリリウム、マグネシウム、カルシウム、ストロンチウム、バリウム、ラジウム) は 2 番目の列 (IIA) に配置されます。周期表の。どちらの金属基も反応性が高いです。これらの金属はすべて、金属を炎で加熱すると独特の炎の色を示すため、燃焼試験を使用して識別できます。
参考文献:
1. Trefil, J. S. (2001). 科学技術百科事典 . Taylor &Francis.
2. Bridget Heos (2010). アルカリ土類金属:ベリリウム、マグネシウム、カルシウム、ストロンチウム、バリウム、ラジウム、 ニューヨーク:ローゼン セントラル.
3. レイモンド フェルナンデス (2008). クラス 10 の生物科学化学 Ratna Sagar P. Ltd.
画像提供:
1.「元素の周期表」Le Van Han Cédric – LeVanHan (GFDL) by Commons Wikimedia