周期表には 18 のグループがあることに注意する必要があります。各グループには、独自の異なるプロパティと特性があります。ハロゲン基も同様です。ハロゲン族の元素は、サイズが小さく、他のグループの中で最も電気陰性度が高いです。コンパクトなサイズと高い電気陰性度により、オキソ酸を形成します。ここで問題は、オキソ酸とは何ですか?ハロゲンのオキソ酸では、ハロゲン原子 (フッ素以外) が酸素原子または水酸化物原子と 1 つまたは複数の結合を形成します。このようにして、すべてのハロゲンがオキソ酸を形成します。しかし、それぞれに異なる特性、用途、構造、およびその他の多くの機能があります。
この記事では、過塩素酸またはオキシ酸塩素について学びます。
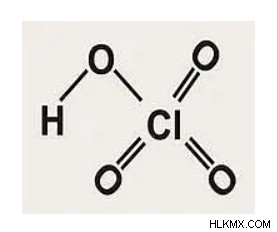
過塩素酸、HClOの構造 4
塩素のオキソ酸なので、過塩素酸や塩酸の中心原子は塩素原子です。 4 つの酸素原子が共有結合しています。正確には、過塩素酸の塩素原子は、3 つの酸素原子と 1 つの水酸基に囲まれています。 3 つの酸素原子はすべて、塩素原子と二重結合を形成します。オクテット規則を満たすことです。塩素原子はその原子価殻を拡張できるため、3 つの酸素原子と二重結合を形成します。水酸基は、単結合を介して塩素原子に結合しています。過塩素酸は水溶液中で容易に放出されるため、水酸化物基の水素によって過塩素酸が最も強い酸になります。
過塩素酸の構造を以下に示します。
過塩素酸、HClO4の調製
この酸を調製するにはいくつかの方法があります。それらのいくつかは
1.過塩素酸から、HClO3 :
過塩素酸は、過塩素酸を加熱することによって調製されます。
3HClO3 + 加熱 → HClO4 + Cl2 + 2O2 + H2 O
2.過塩素酸カリウム、KClO4 から :
無水過塩素酸は、KClO4 の混合物を蒸留することによって得られます。 濃縮H2 SO4 減圧下。
KClO4 + H2 SO4 →HClO4 + KHSO4
3.過塩素酸バリウム、Ba(ClO4 )2 :
過塩素酸溶液はBa(ClO
Ba(ClO4 )2 + H2 SO4 → 2HClO4 + BaSO4 ↓
4.過塩素酸アンモニウムから、NH4 ClO4 :
過塩素酸または過塩素酸溶液は、NH4 を加えることによっても得られます。 ClO4 濃HClに溶かして濃HNO
NH4 ClO4 + 8HCl + 3HNO3 →HClO4 + 2N2 O + 4Cl2 + 7H2 O
過塩素酸、HClO4の性質
過塩素酸または過塩素酸の特性は、物理的性質と化学的性質の 2 つのクラスに分類されます。
過塩素酸の物性は
<オール>過塩素酸 HClO4 の化学的性質 、です
<オール>2HClO4 + P2 O5 → Cl2 O7 + 2HPO3
この反応は、Cl2 の調製に使用されています。 O7 .
- 無水過塩素酸、HClO4 は、無色の流動性吸湿性油状液体です。
- 無水過塩素酸は湿った空気中で激しく発煙します。
- 無水HClO4 多くの熱を除去することによる解放により、シューという音で水に溶けます。
- Zn、Fe などの金属は酸の水溶液に溶解し、可溶性過塩素酸塩を形成します。
Zn + 2HClO4 (aq) → Zn(ClO4 )2 (aq) + H2 ↓
- ヨウ素の懸濁液を HClO4 で加熱すると 、パラ過ヨウ素酸 (H5 IO6 ) が取得されます。
2HClO4 + 私2 + 4H2 O → 2H5 IO6 + Cl2
過塩素酸の使用 HClO4
過塩素酸は多くの目的で使用されます。過塩素酸の主な用途のいくつかを以下に示します:
<オール>過塩素酸による健康被害
過塩素酸は多くの目的に非常に役立ちますが、重大な健康問題を引き起こします.
- この化合物の蒸気を吸入すると、鼻、のど、肺に灼熱感を引き起こします。
- この化合物に長時間さらされると、嘔吐を引き起こします。
- この化合物を摂取すると、胃に水ぶくれや火傷を引き起こす可能性があります.
- 人間の皮膚に対しても非常に腐食性があります.
- その酸化性のため、ほとんどの金属に対して非常に反応性があります。加熱すると、刺激性、腐食性、有毒ガスを放出します。したがって、この化合物は適切な安全対策を講じて取り扱う必要があります。
覚えておくべきポイント
重要な点は次のとおりです:
- 過塩素酸は、式 HClO4 の塩素オキソ酸です。
- 過塩素酸またはヒドロキシドトリオキシドクロリンとも呼ばれます
- 標準温度で無色無臭の水溶液です。
- 危険なほど腐食性があるため、爆発性混合物を容易に形成します。
- 高温では強力な酸化剤として作用しますが、室温では酸性の性質しか示しません。
- 幅広い用途がありますが、宇宙産業では過塩素酸アンモニウムを製造するための重要な用途があります。この過塩素酸アンモニウムはロケット燃料の主要成分です。
- 商業的には、この酸は 70% (重量) の濃度で水中で入手できます。
- 工業生産には主に 2 つの方法があります。
- ブロンステッド・ローリー酸の中で最も強い酸の 1 つです。
安全対策
実験室で過塩素酸を扱うときは、与えられた安全上の注意に従わなければなりません.
- パーソナル ラボ トレーナーのみが対応します。
- 作業中は適切な保護手段を使用してください。
- セルロース、脂質、脂肪などの有機物質で過塩素酸を使用しないでください。
- 過塩素酸をオイルバスまたは直火で加熱しないでください。
- その性質を知る前に、他の化学物質と一緒に使用しないでください。
- 過塩素酸フードは毎回使用後に洗い流してください。
- 不安定な無水物が形成されるため、真空中で過塩素酸を蒸留しないでください。
結論
HClO4、過塩素酸または塩素オキソ酸は、実験室でアルカリ過塩素酸塩と塩酸または過塩素酸バリウムと硫酸との反応によって生成されます。カリウムとナトリウムを分離するために使用されますが、主な機能は重要なロケット燃料成分、つまり過塩素酸アンモニウムを準備することです。また、多くの実験室試験や産業プロセスにおいても利点があります。
よくある質問
<強い>1.過塩素酸を細心の注意を払って使用する必要があるのはなぜですか?
A. 過塩素酸または過塩素酸は、強力な鉱酸の 1 つです。高温で高い酸化力を発揮します。その結果、タンパク質、脂肪、脂質などの有機物の消化に非常に適しています。その分解中に生成される過塩素酸塩は、水に容易に溶けます。有機物と急速に反応するため、時には爆発する可能性があるため、細心の注意を払って取り扱う必要があります。
<強い>2.過塩素酸は最強の酸ですか?
A.はい。過塩素酸は、より活発な酸の 1 つです。これは、過塩素酸または過塩素酸塩が存在するためです。この過塩素酸塩は弱い求核剤であり、他の酸と比較して加水分解を示しません。その結果、水性状態で H+ イオンを容易に放出し、強酸を形成します。
<強い>3.過塩素酸が金属と反応するとどうなりますか?
A. 金属と反応する過塩素酸は、可燃性または爆発性のガスを形成します。酸化性が高く、有機物と接触すると火災や爆発の危険を引き起こす可能性があります。加熱すると分解し、有毒で腐食性のガスを発生します。
<強い>4.過塩素酸とオキシ酸以外に塩素原子を形成するものは何ですか?
A. 塩素は、次亜塩素酸 (HCl+1O)、亜塩素酸 (HCl+3O2)、塩素酸 (HCl+5O3)、および過塩素酸 (HCl+7O4) の 4 つのオキシ酸を形成します。これらの酸では、塩素原子の酸化状態はそれぞれ +1、+3、+5、+7 です。