コア コンセプト
量子数に関するこのチュートリアルでは 、関連付けられた原子の電子の特性をどのように説明できるかを学びます。これらのさまざまなプロパティには、エネルギー レベル、形状、向き、およびスピンが含まれます。 軌道の形についても学びます .
語彙
ノード =電子密度ゼロの点または平面
量子数入門 &軌道形状
量子数は、電子が存在する空間領域である原子軌道を表すために使用されます。これらの数値から、原子軌道内の電子のさまざまな特性を決定できます。パウリの排除原理によれば、各電子は別の電子に固有であることに注意することが重要です。これが真実であるためには、同じ原子内の 2 つの電子が同じ 4 つの量子数を持つことはできません。
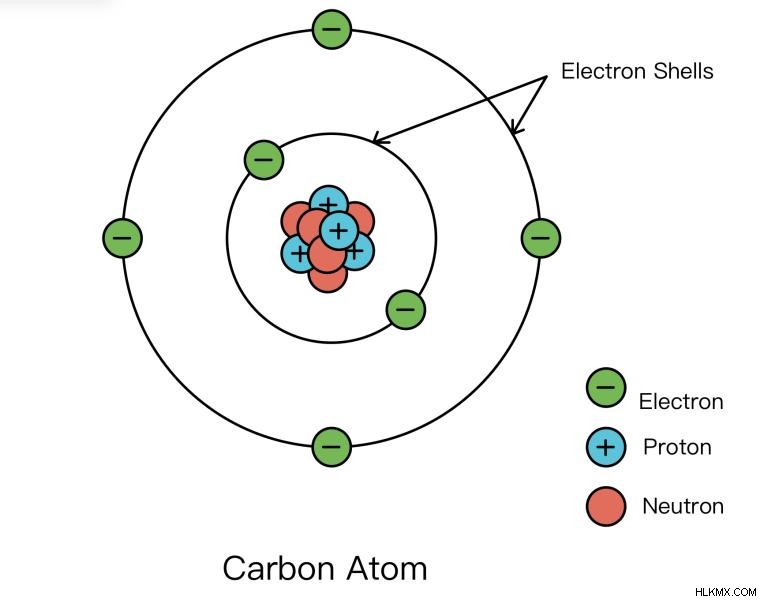
主量子数 (n )
主量子数 (n ) は、軌道の電子殻またはサイズを表します。電子殻は、電子が原子核を周回する原子の一部と考えることができます。ラザフォードが核を発見した方法について学びましょう。
n の唯一の許容値 1 から始まる整数です。より高い n 値は、関連付けられた電子が原子核からさらに離れていることを意味します。たとえば、n の電子 =1 は n の電子よりも原子核にはるかに近い =5. 同じ l の電子を比較する場合 、より高い n を持つ電子とも言えます 値はより高いエネルギーです。より高い n 、電子は、その距離が遠いため、正に帯電した原子核の引力を感じません。電子の負電荷は安定していないため、電子の方がエネルギーが高くなります。
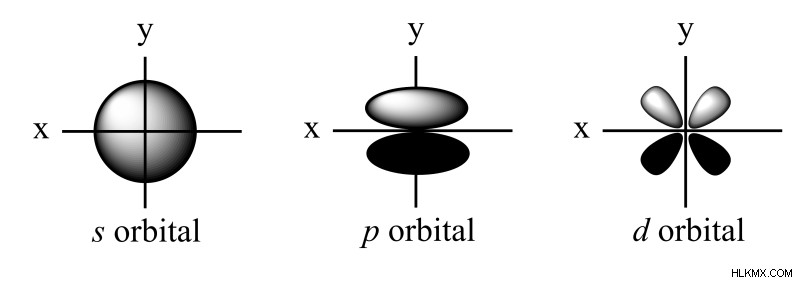
軌道形状 – 角運動量量子数 (l )
s、p、d、f 軌道と呼ばれる 4 種類の軌道があります。それぞれ異なる軌道の形をしています。 s 軌道は、中心に原子核を持つ球形です。 p 軌道はダンベル型で、d 軌道は 5 つのうち 4 つがクローバーの葉型です。最後の d 軌道は、中心にドーナツが付いた細長いダンベルです。
角運動量量子数 (l ) は、軌道のサブシェルまたは形状を記述し、その許容範囲は (0, …, n – 1)。覚えておくべき 4 つの異なる形状があります:s、p、d、および f 軌道です。 l の値 各サブシェルに割り当てられる角度は、角度ノード (平面) の数に基づいています。球体である s 軌道の場合、角度ノードがないため、l =0. 電子密度が 1 つの角度ノードで区切られている p 軌道の場合、l =1. この傾向に従って、d 軌道は l になります。 =2 で、f 軌道は l になります =3、それぞれ 2 つと 3 つの角度ノードがあるため。
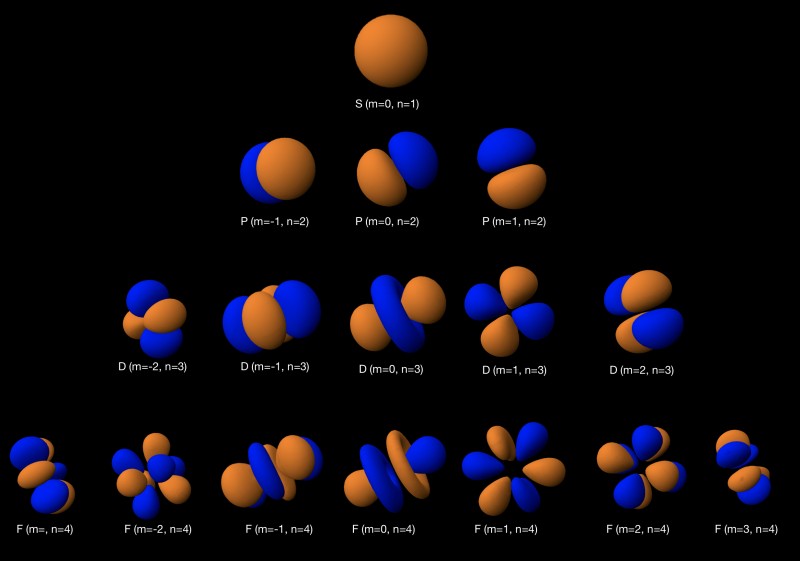
磁気量子数 (ml )
磁気量子数 (ml ) は、3D 空間でのサブシェルのさまざまな方向を示しています。その範囲は (-l , …,l )、つまり、特定の形状を一意に回転できる方法の数については、その数の可能な ml があることを意味します 値。球体を原点の周りで回転させた場合、新たな明確な方向は存在しないため、s 軌道には可能な磁気方向が 1 つしかありません。しかし、p、d、および f 軌道の角度ノードにより、多くの可能な ml があります。 下の図に示すように、値。
スピン量子数 (ms )
スピン量子数 (ms ) は、軌道内の特定の電子のスピンを表します。スピンは +/- ½ のいずれかで、アップ スピンまたはダウン スピンのいずれかを示します。各軌道は最大 2 つの電子を保持でき、完全に満たされた場合、電子は同じスピン方向を共有できません。電子が反対方向を向いていない場合、それはパウリの排他原理に違反していることになります。つまり、2 つの電子が同じ 4 つの量子数を共有することはできません。軌道が完全に占有されていない場合、電子は任意のスピン方向をとることができます。慣例では通常、完全に占有されていない軌道で最初にアップ スピンを割り当てます。
ChemTalk の詳細を読む
アルカンの命名
分子式と実験式
イオン化合物の命名