緩衝能力は、特定の溶液に酸または塩基が加えられたときの pH の変化に対する耐性の尺度です。
高校の化学を覚えているか、化学 101 のような大学のコースを受講した場合は、滴定試験を実施したことになります。個人的には、最初に液体がガラス製フラスコの底に浸透し、溶液がピンクまたはマゼンタの色合いに変わるのを辛抱強く待っていたとき、正直なところ科学者のように感じました!しかし、なぜこの溶液は一定量の化学物質を加えた場合にのみ色が変わるのでしょうか?その答えを得るには、ソリューション固有の特性を理解する必要があります。
(画像クレジット:Pixabay)
バッファ容量:定義
バッファ容量とは何かを説明する前に、まずバッファについて理解する必要があります。 バッファ 限られた量の酸または塩基が添加されたときにpHの変化に抵抗する化合物です。通常、緩衝液の化学組成には、弱酸または弱塩基とその共役塩が含まれます。
さて、バッファ容量 pH の変化に抵抗する緩衝液の効率の尺度として定義できます。この定義は、「有意な変化とは何か?」という点で少し問題があります。1 単位の変化が有意な変化をもたらさない場合もあります。場合によっては、0.1 単位の変更でも大きな違いが生じることがあります。したがって、より明確な定義を与えるために、緩衝能力は、1 リットルの溶液に追加して 1 pH 単位だけ変化させる必要がある強酸または強塩基の量として定義することができます。バッファ容量の式は次のとおりです。 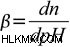 ここで、n は追加された強塩基 (溶液 1 L あたり) に相当するものです。 n モルの酸を添加すると、pH が同じ値だけ変化しますが、反対方向に変化することに注意してください。緩衝能力を pH、pKa、および緩衝濃度と結び付ける式を導き出します。
ここで、n は追加された強塩基 (溶液 1 L あたり) に相当するものです。 n モルの酸を添加すると、pH が同じ値だけ変化しますが、反対方向に変化することに注意してください。緩衝能力を pH、pKa、および緩衝濃度と結び付ける式を導き出します。
バッファ容量の計算
バッファーの方程式がどのように記述されるかを確認したので、上記の方程式にたどり着いた方法をよりよく理解するために、それを導き出してみましょう。この導出を少し簡単にするために、塩基をモノプロティック (1 つのプロトンのみを受け入れる塩基) にします。また、体積も 1 であると仮定します。これは、濃度とモル数を同じ意味で扱うのに役立つからです。私たちが想定する溶液の電荷収支は、次の式で示されます:
[A–]+[OH+]=[B+]+[H+]
[B+] は、溶液中に強塩基濃度が存在することを示します。 [B+] も n です 最初のバッファ容量の式に存在します。ここで、バッファーの総濃度は次の式で与えられます:
Cbuff =[HA]+[A–]
上記の式の[AH]は、より小さな構成要素に分解できます。より大きく、より複雑な化合物がより小さな基本要素に分解されることは、解離定数として知られています。解離定数は、導出の単純化を容易にするのに役立ちます。下式のKaは酸解離定数です。これは、分子がどれだけ容易に酸として作用するかに関係しています。
[HA]=([H+][A–])/Ka
ここで、上記の式をバッファー濃縮液の式に代入すると、次の式が得られます:
Cbuff=([H+][A–])/Ka + [A–]
ここで、[A–] を公約数と最小公倍数として上記の式を簡略化すると、次の式が得られます。
[A–]=(Cbuff+Ka)/(Ka+H+)
先に進む前に、水のイオン化定数として知られる、この導出をきちんとまとめるための前提条件となる 1 つの重要な定義を理解する必要があります。 または水の自己イオン化 . 水の自己イオン化 純水または水溶液中で発生するイオン化反応で、H2O がその水素原子の 1 つの核を失い、水酸化物イオン OH- になります。

(写真提供:マヌエル・アルマグロ・リバス/ウィキメディア・コモンズ)
ここで、電荷平衡方程式、[A–] 当量、および水のイオン化定数を使用して、次の方程式を導き出すことができます:
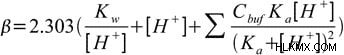 方程式にある最初の 2 つの項は、解のバッファーに依存しません。これらは、高 (または低) pH の溶液が pH 変化に対して耐性があるという事実を表しています。これは、pH が極端な特定の溶液は、緩衝液が存在しなくても変化しにくいことを示しています。
方程式にある最初の 2 つの項は、解のバッファーに依存しません。これらは、高 (または低) pH の溶液が pH 変化に対して耐性があるという事実を表しています。これは、pH が極端な特定の溶液は、緩衝液が存在しなくても変化しにくいことを示しています。
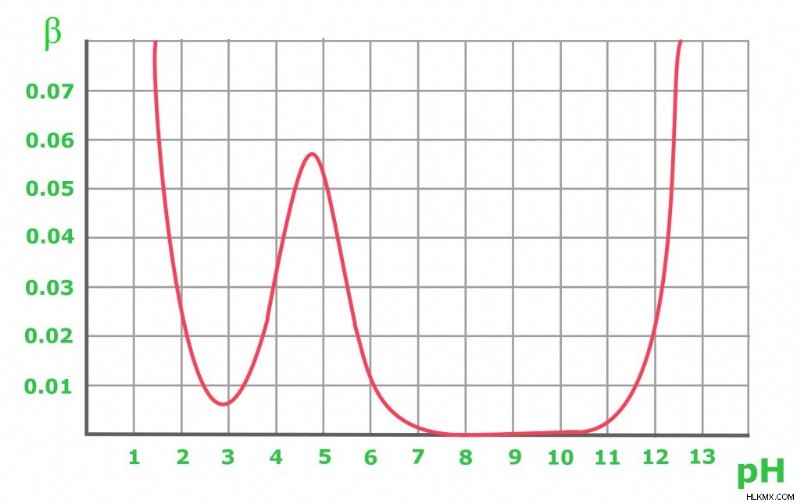 上のグラフは、0.1 M 酢酸緩衝液における緩衝容量の変化を示しています。予想どおり、緩衝液は酸と塩基の添加に抵抗し、等モル溶液を維持します (pH=pKa の場合)。グラフから、緩衝能が pKa 値に近い pH でのみかなり高い値を示していることが明らかです。最適値から遠ざかるほど、溶液の緩衝能は低くなります。 pH 8 ~ 10 の共役塩基を含む溶液の緩衝能はゼロですが、pH が高くなると、強塩基の存在が重要な役割を果たし始めます。 pH 3 未満の純粋な酢酸溶液の場合、pH はすでに十分に低く、H+ 陽イオンの濃度が高いため、変化に耐えることができます。
上のグラフは、0.1 M 酢酸緩衝液における緩衝容量の変化を示しています。予想どおり、緩衝液は酸と塩基の添加に抵抗し、等モル溶液を維持します (pH=pKa の場合)。グラフから、緩衝能が pKa 値に近い pH でのみかなり高い値を示していることが明らかです。最適値から遠ざかるほど、溶液の緩衝能は低くなります。 pH 8 ~ 10 の共役塩基を含む溶液の緩衝能はゼロですが、pH が高くなると、強塩基の存在が重要な役割を果たし始めます。 pH 3 未満の純粋な酢酸溶液の場合、pH はすでに十分に低く、H+ 陽イオンの濃度が高いため、変化に耐えることができます。







