主な違い – 酸化数と酸化状態
酸化数と酸化状態はしばしば同じと見なされます。これは、酸化状態が、特定の原子が存在する化合物の種類に応じて、その原子の酸化数と等しくなる可能性があるためです。ただし、酸化数と酸化状態にはわずかな違いがあります。酸化数と酸化状態の主な違いは、酸化数は、配位錯体の周りのすべての結合がイオン結合である場合の配位錯体の中心原子の電荷です。 一方、酸化状態は、特定の原子が他の原子との間で失う、獲得する、または共有できる電子の数です。
対象となる主な分野
1.酸化数とは
– 定義、ルール、例
2.酸化状態とは
– 定義、ルール、例
3.酸化数と酸化状態の違いは何ですか
– 主な違いの比較
重要な用語:アラビア数字、二座、配位結合、配位錯体、配位数、イオン結合、配位子、単座、酸化数、酸化状態、ローマ数字 
酸化数とは
酸化数は、配位錯体の周りのすべての結合がイオン結合である場合、配位錯体の中心原子の電荷として定義できます。配位錯体は、いくつかの配位子に結合している中央の金属原子で構成される化学構造です。これらは、中心に金属原子が存在するため、金属錯体とも呼ばれます。この中心金属原子は配位中心と呼ばれます。リガンド 配位結合 (配位共有結合) を介して金属原子に結合している化学基です。配位化合物には複数の配位複合体が含まれています。
ほとんどの場合、中心の金属原子は遷移金属 (d ブロック元素) です。配位結合は、電子が豊富な種がその電子対 (1 つまたは 2 つの対) を中心原子に供与するときに形成されます。これらのドナーはリガンドと呼ばれます。配位子は、中性分子または負電荷イオンのいずれかです。この配位結合は、2 つの原子間の電子共有によって形成されるため、共有結合です。中心原子に結合したドナー原子の数は配位数と呼ばれます .
単座配位子または二座配位子のいずれかがあります。一座配位子は、単一の配位結合を介して中心原子と結合しますが、二座配位子は、2 つの配位結合を介して結合します。配位数は、配位複合体の形状を決定します。ただし、配位数は中心原子の酸化数ではありません。しかし、配位数が酸化数と等しい場合もあります。
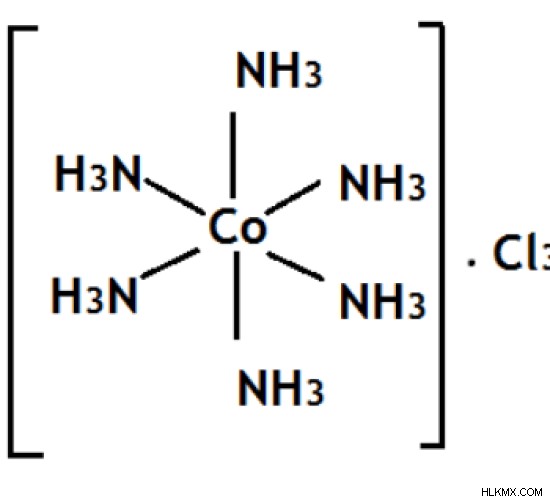
図 01:コバルトの配位錯体
上の画像は [Co (NH3 )6 ] Cl3複合体。コバルト原子に結合したアンモニアの配位子が6つあるため、コバルトの配位数は6です。しかし、コバルトの酸化数は 3 です。なぜなら、酸化数は配位錯体の中心原子の電荷であり、周囲の配位子がすべて取り除かれているからです。 3 つの Cl 原子が -3 の電荷を引き起こし、アンモニア分子が中性に帯電しているため、Cl 原子からの電荷を中和するために、コバルト原子は +3 の電荷を帯びている必要があります。したがって、コバルトの酸化数はCo(III)と表記されます。
酸化状態とは
酸化状態は、特定の原子が失う、獲得する、または別の原子と共有できる電子の数として定義できます。この用語は、配位複合体に限定されるものではありません。酸化状態は、実際には化合物中の原子の酸化度を示します。酸化状態は常に整数で与えられ、原子の電荷を含むヒンドゥーアラビア数字で表されます。
酸化状態を判断するためのルール
原子の酸化状態は、7 つの規則に従って与えられます。
ルール 1
単一元素および単一元素から構成される化合物は、各原子の酸化状態がゼロです。
たとえば、化合物 N2 の窒素 (N) の酸化状態 はゼロです。
ルール 2
化合物の総電荷は、各元素の電荷の合計です。
たとえば、NaCl などの中性種では、総電荷はゼロです。したがって、各元素の酸化状態は Na (+1) と Cl (-1) として与えられる必要があります。
NH4 などのイオン種 、N 原子と H 原子の酸化状態の合計は、全体の電荷に等しくなければなりません。
(N + 4H) =(-3) + (1 x 4) =+1
ルール 3
1 族金属 (1A) の酸化状態は常に +1 であり、2 族金属 (2A) の酸化状態は常に +2 です。
たとえば、リチウム (Li) の酸化状態は常に +1 であり、マグネシウム (Mg) の酸化状態は常に +2 です。
ルール 4
フッ素 (F) の酸化状態は常に -1 です。
F2 中のフッ素の酸化状態を思い出してください。 最初のルールによればゼロです。
ルール 5
結合している他の原子と比較して最も電気陰性度の高い原子には、負の電荷が与えられます。
たとえば、フッ素は水素より電気陰性度が高いです。したがって、HFでは、水素の酸化状態は-1です。しかし通常、水素の酸化状態は +1 です。
ルール 6
通常、水素 (H) の酸素状態は +1 です。
水素原子は容易に電子を失い、陽イオンを形成します。しかし、水素が1A族または2A族の金属と結合している場合、水素の酸化状態は-1です。たとえば、NaH です。
ルール 7
酸素の酸化状態は通常 -2 です。
酸素は電気陰性度が高く、電子を引き付けます。したがって、-2 の酸化状態を容易に形成します。しかし、過酸化物では、2 つの酸素原子が単結合で結合しているため、酸化数は -1 です。
酸化状態は、酸化還元反応における生成物の決定に非常に役立ちます。酸化還元反応は、原子間の電子交換を含む化学反応です。酸化還元反応では、2 つの半反応が並行して発生します。一つは酸化反応、もう一つは還元反応です。酸化反応には原子の酸化状態の増加が含まれ、還元反応には原子の酸化状態の減少が含まれます。
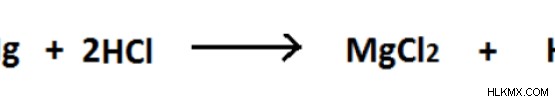
図 02:Mg と H2 の間の酸化還元反応
上記の反応では、Mg は酸化状態がゼロ (0) の単一元素です。しかし、H2 との反応後、 MgCl2 を形成しています 、Mg の酸化状態は +2 です。ここで、Mgの酸化状態が増加します。したがって、このレドックス反応における酸化半反応です。 HCl 中の H の酸化状態は +1 です。しかし積 H2 ゼロ (0) 酸化状態にあります。酸化状態が減少しました。したがって、この酸化還元反応における還元半反応です。
酸化数と酸化状態の違い
定義
酸化数: 酸化数は、配位錯体の周りのすべての結合がイオン結合である場合、配位錯体の中心原子の電荷として定義できます。
酸化状態: 酸化状態は、特定の原子が失う、獲得する、または別の原子と共有できる電子の数として定義できます。
申し込み
酸化数: 配位錯体には酸化数が適用されます。
酸化状態: 酸化状態は、任意の元素または化合物に適用できます。
数の表現
酸化数: 酸化数はローマ数字で表します。
酸化状態: 酸化状態を表すためにヒンドゥーアラビア数字が使用されます。
請求の表現
酸化数: 酸化数は、中心原子の電荷に関する詳細を提供しません.
酸化状態: 酸化状態は、マイナス (-) またはプラス (+) 記号の電荷で表されます。
結論
通常の元素または化合物 (配位錯体ではなく) の場合、酸化状態と酸化数は同じです。しかし、配位化合物を含むすべての化合物を考慮すると、わずかな違いがあります。酸化数と酸化状態の主な違いは、酸化数は、周囲のすべての結合がイオン結合である場合の配位錯体の中心原子の電荷であるのに対し、酸化状態は、特定の原子が失う、獲得する、または電子の数であるということです。別のアトムと共有します。