コア コンセプト
このチュートリアルでは、金属と非金属について紹介します 元素の周期表とその性質.
他の記事で取り上げるトピック
- 金属、非金属、メタロイドの特性
- イオン結合対。共有結合
- 電子親和力
- 電気陰性
- 金属結合
金属
元素周期表の元素の大部分は、金属に分類されます。周期表では、ホウ素、ケイ素、ヒ素、テルル、アスタチンの 5 つの元素を結ぶジグザグ線の左側に金属が配置されています。たまたま線上またはそのすぐ左側にある元素 (ホウ素、シリコン、ゲルマニウム、ヒ素、テルル、アンチモン、およびポロニウム) は、半金属または半金属として分類される場合があります。これは、金属と非金属の両方の性質を持っていることを意味します。
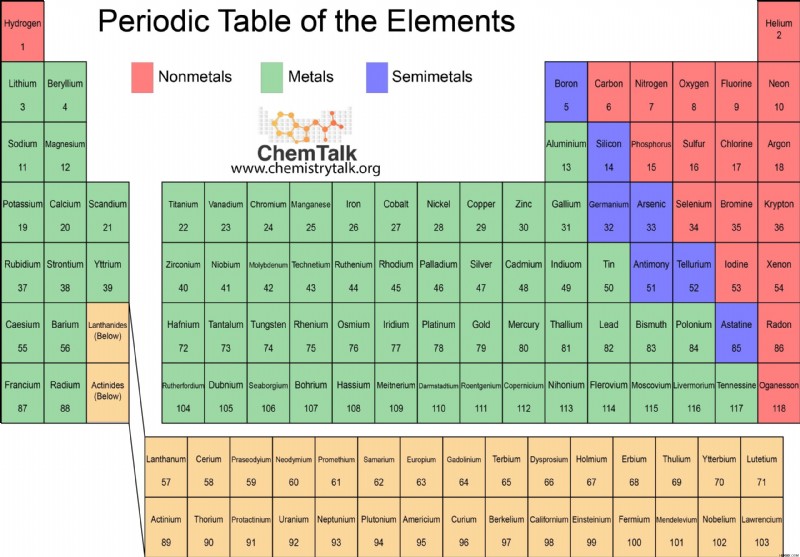
金属の例
周期表でよく知られている金属には、室温で固体として存在する鉄、鉛、アルミニウム、銀、カルシウム、ナトリウムなどがあります。金属として分類される水銀は、周期表で液体として存在する唯一の金属です。周期表の 118 種類の金属のうち、金は最も柔軟です。そのため、ジュエリーが 100% 純金であるとは限りません。
金属の性質
- すべての金属は融点が異なります 、しかし一般的に、すべての金属は高い融点と沸点を持っています.
- 固体として存在するほとんどの金属 室温では、水銀は室温で液体として存在するため、この規則の唯一の例外です。
- 金属は光沢があります つまり、表面は光沢があります。銅は非常に光沢のある金属です。
- 通常、金属は非金属よりも高密度です。
- 一般的に、金属は非常に順応性が高い 、つまり、叩いて薄いシートにすることができます。純金は最も柔軟な要素です。
- 金属は延性です これは、薄いシートに丸めることができることを意味します。
- 最後に、金属は優れた導体です 熱と電気の管理
金属とその電荷
金属は周期表の左側にあるため、イオン化エネルギーと電子親和力が低いことが多く、電子を比較的簡単に放出して金属を陽イオンにすることができます。主族の金属は通常、それらのグループ番号と同じ電荷を形成します。リチウムやナトリウムなどのグループ 1A の金属は +1 の電荷を持ち、マグネシウムやカルシウムなどのグループ 2A の金属は +2 の電荷を持ちます。
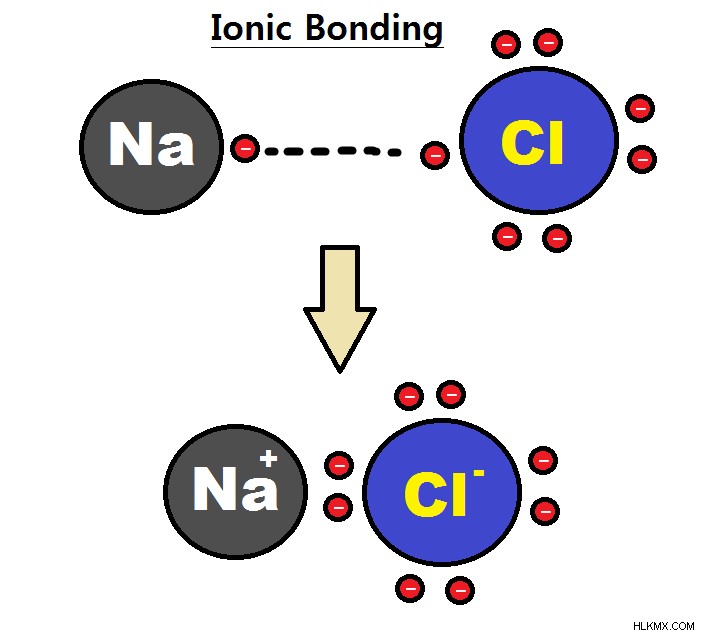
遷移金属に続く金属は を失う可能性があります 軌道と p 軌道電子とそのグループ番号と同じ電荷を形成するか、p を失う可能性があります 電子を軌道に乗せ、その 2 つの を保持します 軌道電子;グループ 4A のスズや鉛などの金属は、+4 または +2 電荷を形成できます。これらの金属が他の非金属と結合するとき、これはイオン結合として知られており、ある種から別の種への電子の移動が発生します。
非金属
非金属は、周期表の元素のごく一部を占めています。周期表では、非金属はホウ素、ケイ素、ヒ素、テルル、アスタチンの元素の間を走るジグザグ線の右側にあります。非金属には、メタロイドの左側にある水素も含まれます。これらの要素の多くは、生物学的役割を持っています。生物は、ほぼ完全に炭素や水素などの非金属で構成されています。
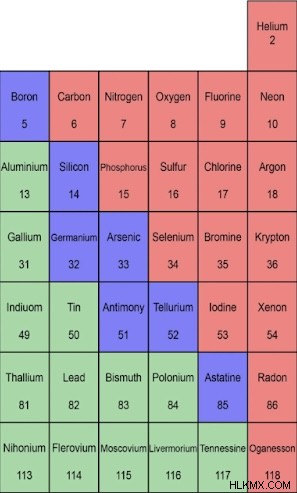
非金属の例
周期表には 17 種類の非金属しかありませんが、いくつかの一般的な例には、私たちが呼吸する空気の大部分を占める酸素と窒素、およびネオンや化学化合物の二酸化炭素などの他のいくつかのガスが含まれます。非結合ヘリウム、ネオン、ラドン、アルゴン、キセノン、クリプトン、およびオガネソンは、希ガスとしても知られており、非金属の塊を構成しています。
非金属の性質
- 大部分の金属は気体の中にあります 状態ですが、固体または液体の状態のものもあります。液体として見つかるかもしれない臭素のように。
- 一般的に、非金属は光沢がありません または光沢があります。
- 非金属は低い 融点と沸点
- 非金属は低密度で存在することが多い .
- 金属とは異なり、非金属は多くの場合非常に伝導性が悪い 熱と電気の管理
非金属とその料金
非金属は高いイオン化エネルギーと高い電子親和力を持っているため、電子を簡単に獲得できますが、はるかに多くの労力をかけて電子を失うため、陰イオンとして分類されます。それらは、最も近い希ガスと同じ数の電子を持つまで、電子を獲得し続けます。彼らの請求は、グループ番号から 8 を引いたものとして分類できます。したがって、グループ 7A の非金属は -1 の電荷を持ち、グループ 6A は -2 の電荷を形成し、グループ 5A は -3 の電荷を形成します。グループ 8A の希ガスは、すでにオクテットを持っているため、結合を形成するのをためらっています。 2 つの非金属が結合すると、共有結合が形成されます。これらは、電子のペアが原子によって共有されるときに発生します。