コア コンセプト
アルカン 有機化学で最も基本的な化合物です。しかし、それらは他の多くの複雑な化合物の骨格を形成するため、非常に重要でもあります.この記事では、アルカンの構造、その命名法、およびその反応のいくつかについて学びます.
他の記事で取り上げるトピック
- 椅子の構造
- 機能グループ
- アルカンの命名
- シクロアルカンの命名
- ニューマン プロジェクション
- 立体障害
- 構造異性体
アルカン構造
アルカンは炭化水素 (完全に炭素と水素からなる化合物) であり、その結合はすべてシグマ (σ) 結合です。つまり、アルカンの炭素は、互いにおよび水素原子と単結合を形成します。このため、アルカンは飽和炭化水素と呼ばれ、二重結合または三重結合がないため、各炭素が可能な最大数の水素原子に結合することができます。


さらに、アルカンは互いに結合して分岐アルカンを形成することができます。または、それらは環状形成に入り、シクロアルカンを形成する可能性があります。これらの構造については、記事の後半で詳しく説明します。
アルカンに関する簡単な事実
- 構造:互いにおよび水素原子に単結合した炭素原子
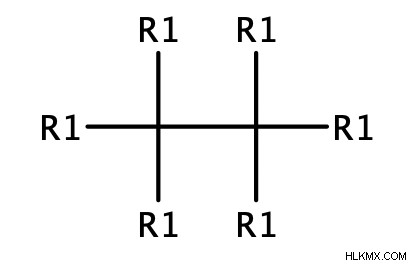
- 一般式:Cn H2n+2
- pH:中性
- pKa:30以上
- 溶解性:水には不溶ですが、非極性有機溶媒には溶けます
- C-C 結合長:1.53 Å
- C–C 結合強度:356 kJ mol
- IR 分光法:アルカンの C–H 結合は、約 2850 – 3000 cm でシグナルを出します
アルカン異性
構造異性体
炭素数が 4 を超えるアルカンは、構造異性体として存在する可能性があります。つまり、同じ分子式は、異なる構造を持つ多くの化合物を表すことができます。これらの構造の 1 つは直鎖アルカン (各炭素は最大 2 つの他の炭素にしか結合できない) であり、残りは分岐アルカン (各炭素は最大 4 つの他の炭素に結合できる) です。
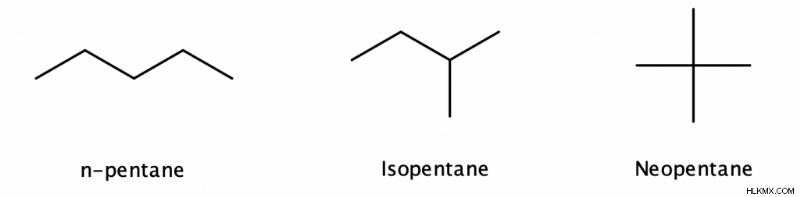
アルカンの炭素数が多いほど、構造異性体が多くなります。たとえば、C5 H12 C9 には 3 つの異性体があります。 H20 35 の異性体があります。
コンフォーマー
アルカンは C–C 結合の周りを自由に回転できるため、3D 空間にさまざまな形状 (または「コンフォメーション」) として存在できます。自分の腕を考えてみてください。ねじったり曲げたりしても、自分の腕のままです。腕の構造は変わらず、形だけが変わります。一部のアルカン配座は安定 (低エネルギー) ですが、一部は不安定 (高エネルギー) です。
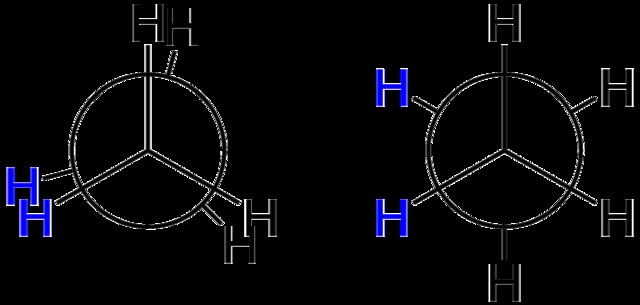
ニューマン プロジェクション
このトピックについては、この記事 Newman Projections で詳しく説明しました。
基本的に、ニューマン プロジェクションは 2 つのシーリング ファンが互いに重なり合っていると考えてください。ブレードが互いに離れているほど、コンフォメーションはより安定します。
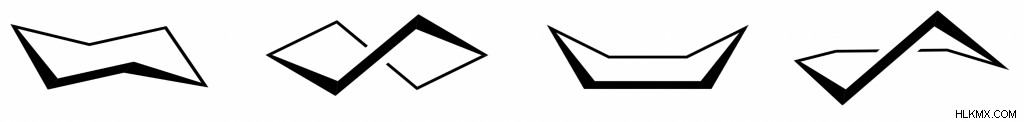
シクロヘキサンの配座
シクロヘキサンはねじれて多くの形にできますが、おそらく最もよく知られているのはそのいす形構造です。これは、いす型配座がシクロヘキサンの最も安定な配座であるためです。椅子は、角度の歪み、楕円形の歪み、および立体的な歪みをほとんど経験しません。
シクロヘキサンのその他の一般的なコンフォメーションは (安定性の降順で):ツイスト ボート、ボート、ハーフチェアです。
アルカン命名法
このトピックについては、アルカンの命名、シクロアルカンの命名という記事で詳しく説明しました。したがって、以下の情報は単なる復習になります。
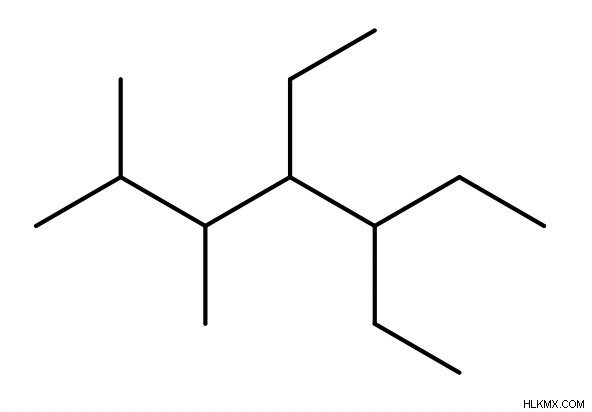
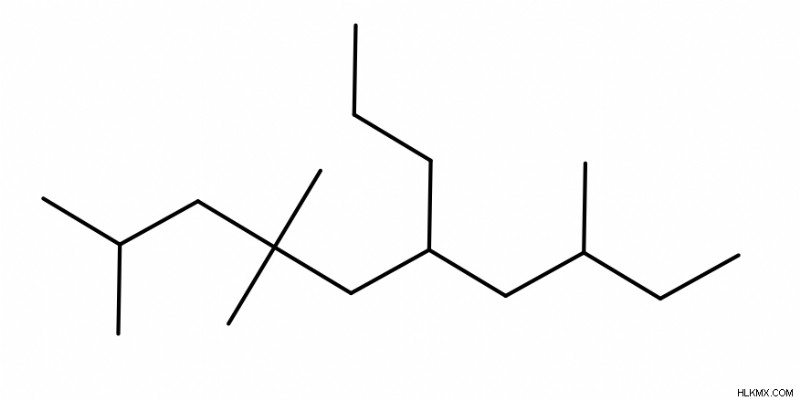
アルカンの命名
- アルカン (他の官能基を含まない純粋なアルカン) に名前を付けるには、まず親鎖を特定します。これは最長の鎖 (最大数の炭素で構成されます) です。
- 次に、「-yl」の前に接頭辞を追加して、置換基 (存在する場合) に名前を付けます。これらのプレフィックスは、親チェーンの名前付けに使用されるプレフィックスと同じです (例:meth、eth、prop など)。いくつかの例を次に示します:メチル、エチル、およびプロピル。
- 次に、各置換基に番号を割り当てて、分子内の位置を示します。遭遇する最初の置換基に可能な限り小さい数を割り当てる必要があります。同点の場合は、2 番目の置換基を可能な限り小さい数に割り当てます (ただし、もちろん、最初の置換基よりも大きい値です)。
- また、置換基の前にジ、トリ、テトラなどの別の接頭辞を付けて、その種類の置換基が分子にいくつ存在するかを示すことを忘れないでください。
- 最後に、分子名の末尾に接尾辞「ane」を付けます。
シクロアルカンの命名
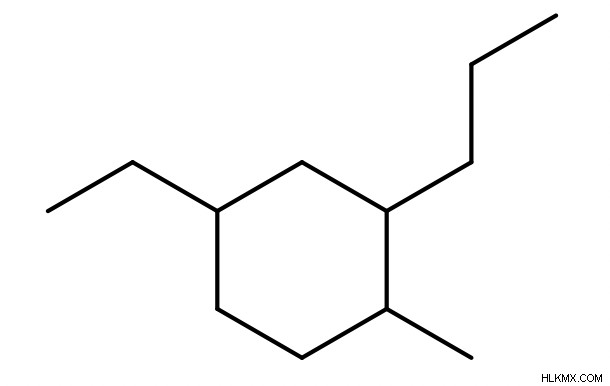
環が親鎖である場合 (つまり、炭素原子が最も多い場合)、親鎖の名前の前に接頭辞「シクロ」を追加します。
環が単なる置換基である場合 (つまり、環よりも長い炭素鎖が存在する場合)、環置換基の名前の前に接頭辞「シクロ」を追加します。
二環式化合物の命名
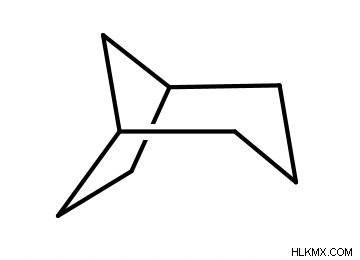
2 つの環が互いに融合すると、二環式化合物が形成されます。環が融合している 2 つの炭素は「ブリッジヘッド」と呼ばれます。二環式化合物を命名するための形式は次のとおりです:置換基 + bicyclo[a.b.c] + 親名.
まず、2 つの縮合環を形成する炭素の総数を数えることで、親の名前を割り出します。次に、橋頭堡を除いて、一方の環の炭素数、もう一方の環の炭素数、橋頭堡間の炭素数を数えます。次に、これらの数値を高いものから低いものへとランク付けします。これは、a、b、および c の順序に対応します (a が最も高く、c が最も低い)。
アルカンとの反応
一般的な反応の傾向
アルカンは非常に不活性で、あまり反応しません。化学者が官能基を列挙する際にしばしばアルカンを省略するのはこのためです。それにもかかわらず、アルカンの燃焼反応は化学でよく知られている反応の 1 つであり、アルカンのハロゲン化は、より複雑な分子の合成に役立つことが証明されています。
アルカンの調製
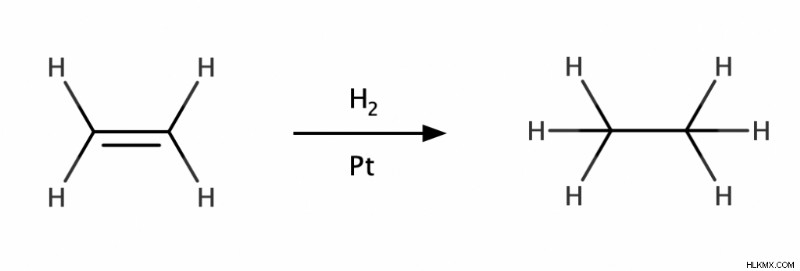
アルケンから
アルケンは、水素化反応を経てアルカンを与えることができます。水素化反応では、水素分子 (H
カルボニルから
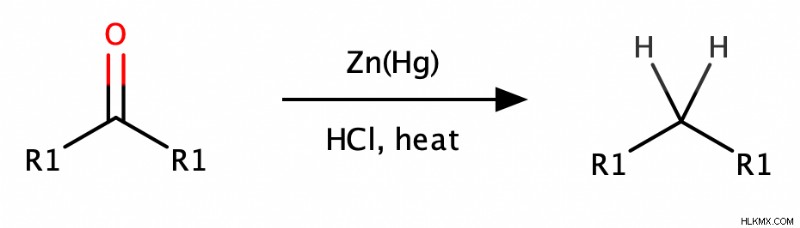
化学者がカルボニル (アルデヒドとケトン) をアルカンに還元するために使用する 2 つの一般的な方法があります。
- クレメンゼン還元では、酸性条件下でカルボニルを亜鉛アマルガム (表面が亜鉛と水銀の合金である亜鉛) で処理します。
- ウォルフ・キシュナー還元では、最初にカルボニルをヒドラジン (NH2 NH2 ) そして、塩基性条件下での前記ヒドラゾンの還元。
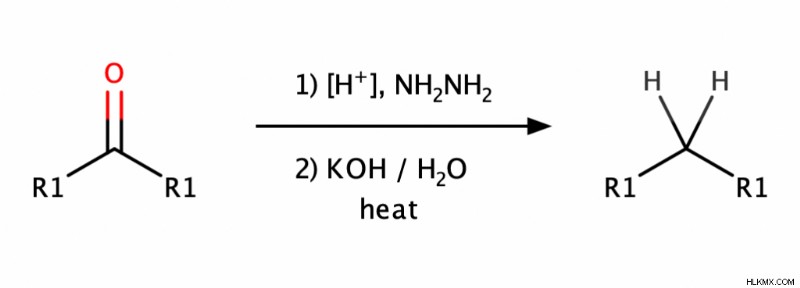
アルカンの反応
完全燃焼
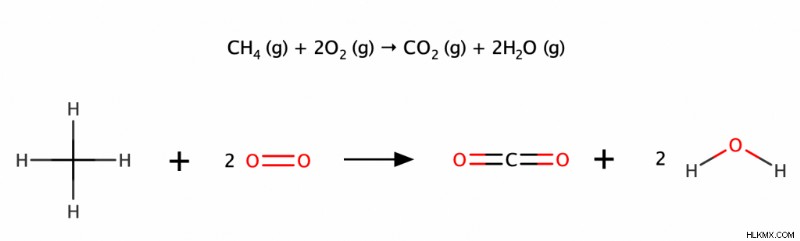
完全燃焼には、過剰な酸素存在下でのアルカンの燃焼が含まれます。より具体的には、アルカンと酸素ガスを組み合わせて二酸化炭素と水を生成します。この反応は非常に発熱性であり、結果として熱と光を放出します。
不完全燃焼
不完全燃焼反応は、完全燃焼反応と非常によく似ています。どちらも発熱性で、熱と光を放出します。主な違いは、不完全燃焼では、アルカンが限られた (不十分な) 酸素ガスの供給で燃焼されることです。結果として生じる生成物は、水と一酸化炭素 (非常に有毒) または炭素のいずれかです。その理由を理解するには、燃焼反応ではアルカンのすべての結合が切断され、水素原子が最初に酸化される (水を形成する) ことを思い出さなければなりません。酸素の供給が限られているため、炭素が二酸化炭素を形成するのに十分な酸素が残っていません。したがって、酸素の供給がさらに制限されている場合、炭素は一酸化炭素または炭素だけで解決する必要があります.
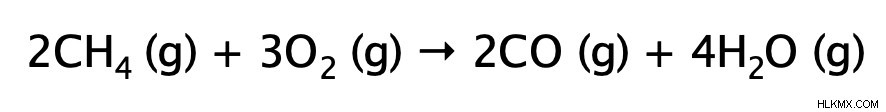
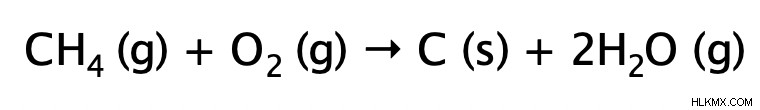
ハロゲン化
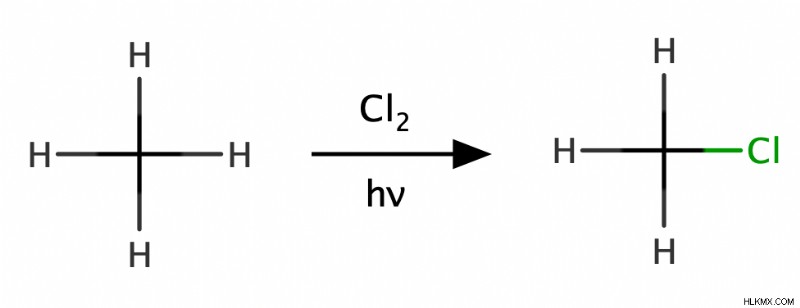
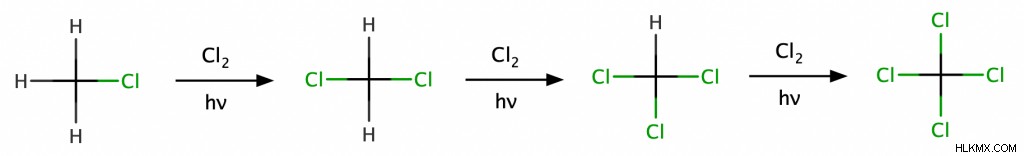
アルカンの臭素化と塩素化は、最も一般的なフリーラジカル反応の 1 つです。この例では、メタンを Cl2 で処理することにより、メタンの塩素化を達成します。 熱や光などのエネルギー源の存在下で。これにより、メタンの水素の 1 つが塩素原子に置き換えられ、クロロメタン (CH3 Cl)。したがって、化学者はこの反応を置換反応として分類します。また、過剰Cl2の程度によっては つまり、クロロメタンはさらに塩素化されて、ジクロロメタン (CH2 Cl2 )、クロロホルム (CHCl3 )、または四塩化炭素 (CCl4 ).
参考文献
- アミノ官能基
- カルボン酸官能基
- グリニャール試薬
- 重要な要素である炭素