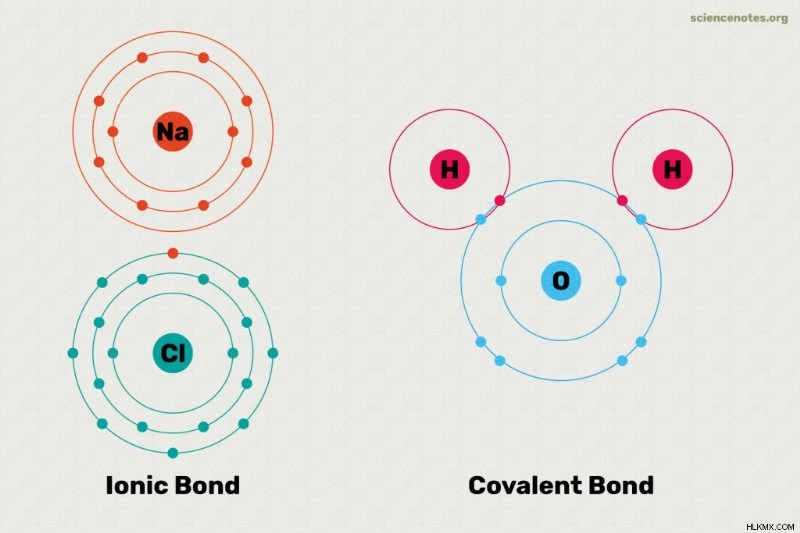
イオン結合と共有結合は、化学結合の 2 つの主なタイプです。化学結合は、2 つ以上の原子またはイオン間で形成されるリンクです。イオン結合と共有結合の主な違いは、電子が結合内の原子間でどれだけ均等に共有されるかです。ここでは、イオン結合と共有結合の違いの説明、各結合タイプの例、形成される結合タイプの見分け方について説明します。
キーポイント
- 化学結合には、主にイオン結合と共有結合の 2 種類があります。金属は、金属結合と呼ばれる 3 番目のタイプの化学結合を介して結合します。
- イオン結合と共有結合の主な違いは、共有結合では原子間で電子が共有されるのに対し、イオン結合では基本的に 1 つの原子が別の原子に電子を供与することです。
- 金属と非金属の間にイオン結合が形成されます。 2 つの非金属間に共有結合が形成されます。 2 つの金属の間に金属結合が形成されます。
- 共有結合は、純粋または真の共有結合と極性共有結合に分類されます。電子は、純粋な共有結合では原子間で均等に共有されますが、極性共有結合では不均等に共有されます (1 つの原子と他の原子よりも多くの時間を費やします)。
イオン結合
イオン結合では、1 つの原子が別の原子に電子を供与します。これにより、両方の原子が安定します。一方の原子は本質的に電子を獲得し、もう一方はそれを失うため、イオン結合は極性です。つまり、結合の一方の原子は正電荷を持ち、もう一方の原子は負電荷を持ちます。多くの場合、これらの原子は水中でイオンに解離します。イオン結合に関与する原子は、互いに異なる電気陰性度の値を持っています。電気陰性度の値の表を見ると、金属と非金属の間でイオン結合が発生していることがわかります。イオン結合を有する化合物の例には、食卓塩(NaCl)などの塩が含まれる。塩では、ナトリウム原子が電子を供与するため、水中で Na イオンが生成されますが、塩素原子は電子を獲得して水中で Cl イオンになります。

共有結合
原子は、共有結合で共有電子によって結合されています。真の共有結合では、原子は互いに同じ電気陰性度の値を持ちます。このタイプの共有結合は、水素 (H
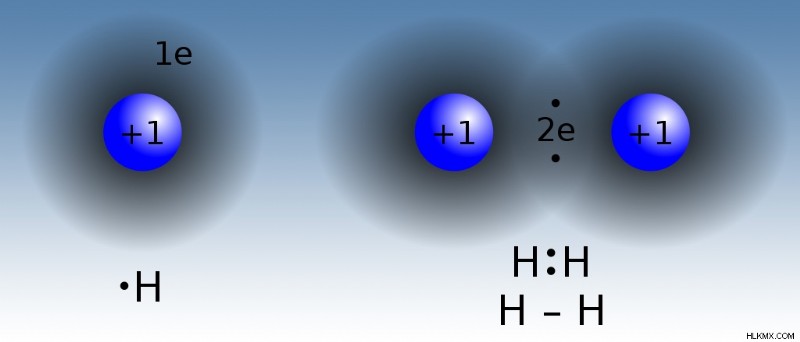
イオン結合と共有結合のまとめ
以下は、イオン結合と共有結合の違い、それらの特性、およびそれらを認識する方法の簡単な要約です:
| イオン結合 | 共有結合 | |
| 説明 | 金属と非金属の結合。非金属は電子を引き付けるので、金属がその電子を非金属に供与するようなものです. | 同様の電気陰性度を持つ 2 つの非金属間の結合。原子は外側の軌道で電子を共有します。 |
| 電気陰性度 | 参加者間の電気陰性度の差が大きい。 | 参加者間の電気陰性度の差がゼロまたは小さい |
| 極性 | 高い | 低い |
| シェイプ | 明確な形はありません | 明確な形 |
| 融点 | 高い | 低い |
| 沸点 | 高い | 低い |
| 室温での状態 | ソリッド | 液体または気体 |
| 例 | 塩化ナトリウム (NaCl)、硫酸 (H2 SO4 ) | メタン (CH4 )、塩酸 (HCl) |
| 化学種 | 金属と非金属 (水素はどちらにも作用することに注意してください) | 2 つの非金属 |
メタリックボンド
金属結合は、別のタイプの化学結合です。金属結合では、結合電子は原子の格子全体で非局在化されます。金属結合はイオン結合に似ています。しかし、イオン結合では、結合電子の位置は静的であり、結合参加者間の電気陰性度の違いはほとんどまたはまったくない場合があります。金属結合では、電子はある原子から別の原子に自由に流れることができます。この能力は、電気および熱伝導性、光沢、引張強度、および延性などの古典的な金属特性の多くにつながります。金属や合金の原子は、金属結合の一例です。
参考文献
- レイドラー、K. J. (1993). 物理化学の世界 .オックスフォード大学出版局。 ISBN 978-0-19-855919-1.
- ラングミュア、アーヴィング (1919)。 「原子と分子における電子の配置」。 アメリカ化学会誌 . 41 (6):868–934. doi:10.1021/ja02227a002
- ルイス、ギルバート N. (1916)。 「原子と分子」。 アメリカ化学会誌 . 38 (4):772. doi:10.1021/ja02261a002
- ポーリング、ライナス (1960)。 化学結合の性質と分子と結晶の構造:現代の構造化学の紹介 .コーネル大学出版局。 ISBN 0-801-40333-2 doi:10.1021/ja01355a027