その効力を評価するために、特定の過マンガン酸カリウム溶液の強度を標準的な硫酸第一鉄アンモニウム (モール塩) 溶液と比較すること。
理論によれば、硫酸の存在下では、過マンガン酸カリウムは強力な酸化剤です。モール塩は、単結晶構造を形成し、式 (NH4)2 を持つ複塩です。 FeSO4。 6H2O。モール塩とも呼ばれます。モール塩は、化学名で硫酸鉄アンモニウムと呼ばれます。
なお、この滴定ではモール塩が還元剤、過マンガン酸カリウムが酸化剤となります。したがって、モール塩と過マンガン酸カリウムの間の反応は、酸化還元反応として分類されます。このプロセスは、モール塩の第一鉄イオンが酸化され、+7 酸化状態にある過マンガン酸カリウムに含まれるピンク色のマンガンが無色のマンガン イオン (Mn2+) に還元されるために発生します。

この滴定は、実験室で行われる酸化還元滴定に基づいています。酸性媒体の存在下で過マンガン酸カリウム溶液に対して硫酸第一鉄アンモニウム溶液を滴定するために硫酸を使用すると、結果は陽性です。酸化マンガンの沈殿を防ぐために、酸性媒体を使用することが重要です。 KMnO4 が反応の自己指示薬として機能するため、この場合は過マンガン酸滴定として知られています。
実験
必要な資料を指定してください。
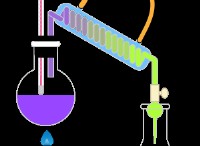
<オール>装置のセットアップ:
ビュレットには、KMnO4 溶液を使用しました。
三角フラスコで、硫酸第一鉄アンモニウム (モール塩) 10 mL と硫酸指示薬 (硫酸指示薬 – 自己指示薬) (KMnO4) 1 mL を混ぜ合わせます。
ポイントオブノーリターン – 無色から永続的な淡いピンク色
KMnO4を用いたモール塩の滴定
手順:(a) 次の手順に従って、硫酸第一鉄アンモニウムの 0.05M 標準溶液を調製します。
規定度 0.05N の溶液 250ml に必要なモール塩の量を決定するには、次の式を使用します。
モール塩のモル質量は 392 g/mol (グラム/モル) です。
強度 =正常性 x 等価重量 =(1/20) x 392 =19.6 g/L 強度 =正常性 x 等価重量
250mL の N/20 モール塩溶液を調製する場合、必要なモール塩の量は (19.6/1000) x 250 =4.9 グラム (分子量) です。
化学天秤を使用して、空の時計皿の重さを量り、その重さを確認します。
化学天秤でモール塩 4.9g の重量を測定して記録します。
漏斗を使ってモール塩をメスフラスコに入れ、漏斗を捨てます。
漏斗をフラスコから取り外し、漏斗を所定の位置に保持したまま蒸留水で洗浄します。
純水を使用して溶液を規定の点まで上げ、モール塩が完全に溶解していることを確認します。
この溶液にはモール塩の 0.05N 標準溶液が使用されています。
過マンガン酸カリウム溶液と従来の硫酸第一鉄アンモニウム (モール塩) 溶液を比較するために、次の手順を使用しました。
ビュレットとピペットを蒸留水で洗ってから、それらの中に入れる溶液ですすいでください。
過マンガン酸カリウム溶液を使用してビュレットをすすぎ、ビュレットに過マンガン酸カリウム溶液を満たします。
ビュレットはビュレット スタンドに固定し、白いタイルをビュレットの下に置いて終端を適切に配置する必要があります。
ピペットと三角フラスコを溶液から取り出し、通常の硫酸第一鉄溶液ですすいでください。
滅菌チップを使用して、10ml の 0.05N 標準モール塩溶液をピペットで三角フラスコに入れます。
マンガンの酸化と二酸化マンガンの形成を避けるために、硫酸を試験管に追加する必要があります。
滴定プロセスを開始する前に、ビュレットの最初の測定値を心に留めておいてください。
滴定手順が開始されました。フラスコ内の溶液を穏やかにかき混ぜながら、過マンガン酸カリウム溶液に対して溶液を滴定します。
最初に、硫酸鉄アンモニウムを使用して溶液から KMnO4 の紫色を取り除きます。恒久的なピンク色の出現は、プロセスの完了を示します。
一致する値が得られるまで、滴定プロセスを続けます。
上部メニスカスは、ビュレットの測定値に書き留めておく必要があります。
測定値をメモして、下にある観察表に入力して、溶液中に存在する KMnO4 の量を計算します。
結論
したがって、提供された KMnO4 溶液のモル濃度は、溶液 1 リットルあたりのモル数であると最終的に結論付けることができます。サンプル中の過マンガン酸カリウム溶液の濃度はg/Lです。過マンガン酸カリウムは黒い化合物なので、上部メニスカスを注意深く読むことが重要です。ピペットとビュレットは使用前によくすすいでください。過マンガン酸カリウムの酸性化は、弱硫酸で行う必要があります。実験を開始する前に、すべての装置を蒸留水で十分に洗浄し、使用する溶液で十分にすすいでください。エンドポイントに到達したら、平均的な結果に落ち着くのではなく、正しい読み取り値を取得する必要があります。 KMnO4 の影響を受ける可能性があるため、ゴム製のコルク ビュレットの使用はお勧めしません。ビュレットの読み取り中に、アンチパラレル カードまたは自動視差カードを使用します。未知の解の強度を計算する際に使用する小数点以下の桁数は 2 桁以内にする必要があります。