化合物の異性体は、同じ化学式を持つ分子として定義できますが、空間方向または構造配置が異なります。
単純な有機分子、ペンタン (C5H12) の例を見てみましょう。
H3C – CH2 – CH2 – CH2 – CH3 (直鎖)
H3C – CH (CH3)- CH2 – CH3(1 つのメチル基が結合した分岐鎖左から2番目の炭素)
H3C – C(CH3)2 – CH3 (4 つのメチル基が結合している炭素原子があります)添付)
上記はすべてペンタンの異性体で、化学式は同じですが構造が異なります。
異性には、構造異性と立体異性の 2 種類があります。前者では、化学式は同じですが、ペンタンの例に見られるように、分子と原子の結合が異なる場合があります。
しかし、立体異性では、空間配置のみに違いがあります。立体異性は、さらに幾何異性と光学異性に分けることができます。
配位化合物ノートにおける幾何異性
複数の種類の配位子が金属に結合している必要があります。つまり、化合物はヘテロレプティックでなければなりません。
AB2C2 フォームの正方形平面化合物:
それらはシス型とトランス型で存在します。トランスは、同じ配位子が互いに反対であるときです。
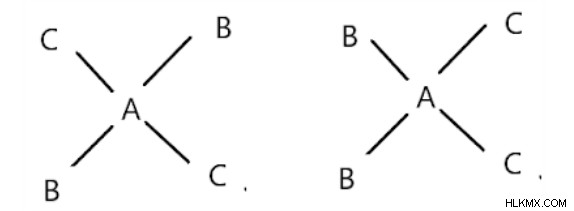
Cis フォームを変換
最初の構造はトランス、2 番目の構造はシスです。
[Pt(NH3)2Cl2] の例を見てみましょう
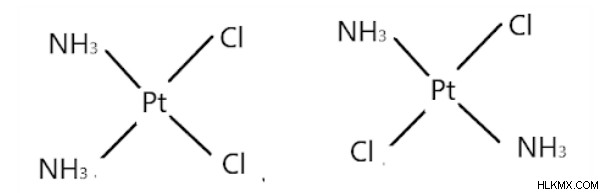
シス形 トランス形
最初の化合物はcis-ジアミンジクロロ白金(II)です。 2 つの塩化物イオンが互いに隣接しており、2 つのアミン分子も互いに隣接しています。
2番目の化合物はトランス-ジアミンジクロロ白金(II)です。 2 つのアミン分子と塩化物分子は、それぞれ互いに反対側に配置されます。
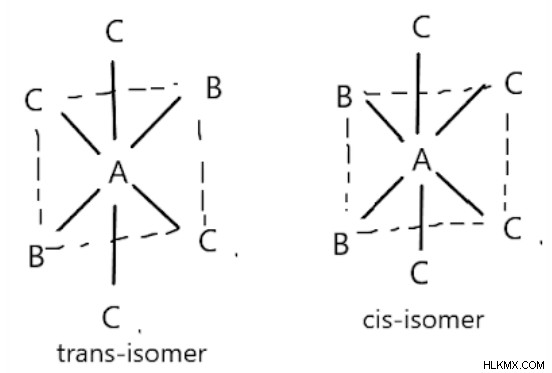
AB2C4 形式の八面体化合物:
B の位置によって、シス体とトランス体が存在します。B が反対の場合はトランス体になります。そうでなければ、シス異性体になります。
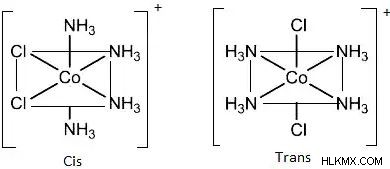
化合物 [Co(NH3)4Cl2]+ は、シス型とトランス型で存在する八面体化合物です。最初の図はシス異性体を表し、2 番目の図は化合物のトランス異性体を示します。
AB3C3 形式の八面体化合物:
それらは fac および mer 形式で存在します。八面体の隣接する頂点に配位子が存在する場合、Fac フォームです。 mer 型では、左図のように、同じタイプの配位子の 1 つのペアが互いに反対になります。配位子は、右図のように、多面体の子午線の周りに配置されていると言われています。
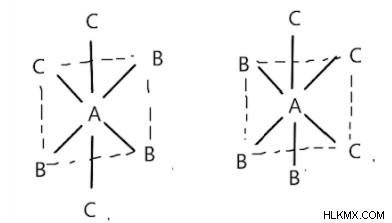
Mer 異性体 Fac 異性体
[Co(NH3)3(NO2)3] は、次のように fac および mer の形で存在します:
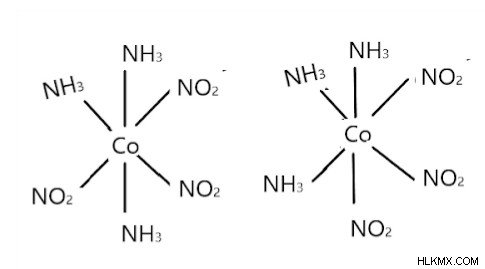
左が mer で右が fac です。
配位化合物における光学異性の注意事項
配位化合物の光学異性体は重ね合わせることができない鏡像です。これは、中心金属イオンに配位した二座配位子を持つ八面体化合物で最も一般的に観察されます。例:[Co(en)3]3+
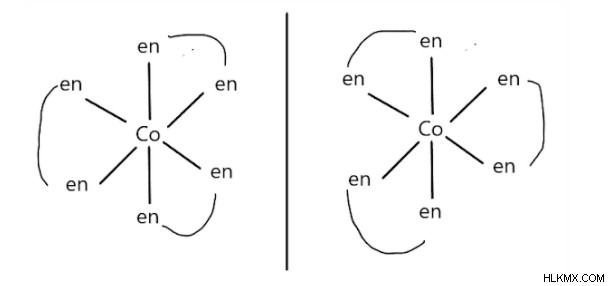
左異性体はデクストロ (偏光面を右方向に回転させる) であり、右異性体はラエボ (偏光面を左方向に回転させる) です。
配位化合物における構造異性
さらに次のタイプに分類できます:
<オール>結合異性
配位異性
イオン化異性
溶媒和異性
配位化合物における結合異性
このタイプの異性は、両座配位子を持つ錯体に存在します。配位子は、2 つのドナー サイトを介して金属イオンと配位できます。アンビデンテート配位子の例はチオシアネート (SCN-) で、これは窒素原子または硫黄原子 (NCS-) を介して配位することができます。
配位化合物における配位異性
これは、2 つの配位圏 (1 つはカチオン、もう 1 つはアニオン) を持つ化合物に存在します。リガンドは、2 つのエンティティ間で交換できます。例は [Co(NH3)6][Cr(CN)6] です。この場合、Co との配位圏はカチオン性で、もう一方はアニオン性です。ただし、配位子が交換されると、[Cr(NH3)6][Co(CN)6] になります。
配位化合物のイオン化異性
配位圏の外側のイオンが、金属中心に直接結合している配位子を置き換えるときに発生します。 [Co(NH3)5(SO4)]Br は対イオンとして臭化物を持っています。ただし、Br- は配位圏内の硫酸塩を置換して [Co(NH3)5Br]SO4 を生成します。
配位化合物における溶媒和異性
溶媒が配位子として作用する一種のイオン化異性です。たとえば、[Cr(H2O)6]Cl3 では、1 つの塩化物対アニオンが水配位子の 1 つを置き換えて、[Cr(H2O)5Cl]Cl.H2O
になります。結論
配位化合物の異性には、構造異性と立体異性の 2 種類があります。立体異性は、異性体の空間配置が異なる場合です。これもまた、幾何学的と光学的の 2 つのタイプがあります。幾何異性体は、シス型とトランス型、または fac 型と mer 型で存在する可能性があります。構造異性は、結合異性、配位異性、イオン化異性、溶媒和異性の 4 つのタイプに分類できます。







