不安定な元素は通常、電子を失ったり、獲得したり、共有したりして、他の元素と結合します。これを化学結合と言います。通常、元素は価電子の助けを借りてのみ他の元素と結合します。価電子は、原子の最も外側の殻に存在する電子です。これらは核から遠く離れており、他の要素との結合に容易に関与できます。
ハイブリダイゼーションは、エネルギーが異なる中心原子の原子軌道の混合と、形状とエネルギーが等しい同数の混成軌道への再分配を伴う現象です。ハイブリダイゼーションは中心原子でのみ発生します。共有結合分子では、原子価の高い元素が中心原子と見なされます。
ハイブリダイゼーションの目的
ハイブリダイゼーションは、共有分子内および中心原子の原子軌道間で発生します。ハイブリダイゼーションは、すべての共有結合分子で発生するわけではなく、メタン、アンモニアなどのヘテロ原子分子で発生します。ハイブリダイゼーションは、原子価殻の電子が異なるエネルギーと形状の軌道に存在する中心原子で発生します。
ハイブリダイゼーションの重要性
中心原子でハイブリダイゼーションが起こり、エネルギーの等しい軌道が得られ、エネルギーの等しい軌道の重なりが効果的です。ハイブリダイゼーションは、2 つの要素間で形成される結合の種類を知るのに役立ちます。共有結合した原子間に形成される結合には、シグマ結合とパイ結合の 2 種類があります。
シグマ結合:シグマ結合は、軌道に存在する電子の共有によって形成される共有結合です。軌道間で観察される重なりのタイプは、正面重なりまたは軸間重なりです。このタイプの重なりは、軌道の強い重なりにつながり、したがってより強い結合につながります。これは、最小エネルギーの安定した結合です。
Pi 結合:Pi 結合は、軌道に存在する電子の共有によって形成される共有結合です。軌道間に観察される重なりのタイプは、横方向の重なりまたは平行な重なりです。横方向に重なり合うと、結合が弱くなり、エネルギーが高くなり、安定性が低下します。
シグマ結合はより強い結合であり、独立して存在できますが、パイ結合はより弱く、独立して存在することはできません.
三ヨウ化物イオンでのハイブリダイゼーション
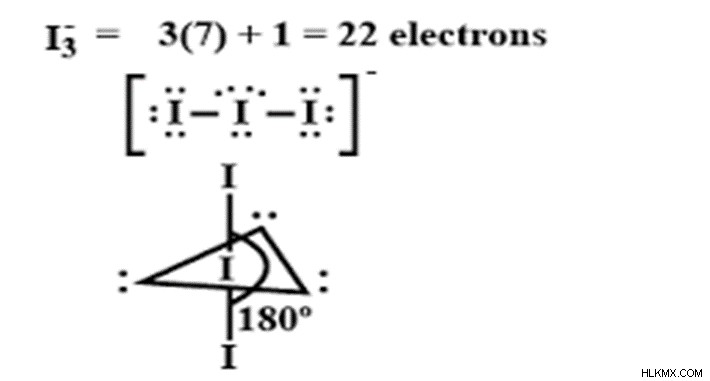
三ヨウ化物イオンは、式 (I3-) のヨウ素化合物です。化合物の名前は -ide という用語で終わります。これは、二元化合物で陰イオンであることを意味します。このイオンは線形で対称です。この化合物では、ヨウ素が中心原子で、最外殻に 7 つの電子があります。
I – 原子番号- 53
原子価電子構成 – [Kr] 4d10 5s2 5p5
ヨウ素はハロゲン族に属し、オクテット配置より 1 個少ない電子を持っています。ヨウ素は、5s、5p、および 4d 軌道に存在する 7 つの電子すべてを使用して混成軌道を形成します。 I3- は、I2 分子が me- イオンと結合して形成される線状イオンであり、I2 分子がアクセプターとして機能し、I- が電子供与体として機能します。 I3-がsp3ハイブリダイゼーションを受けるハイブリダイゼーション。
要素の混成を計算する式:
混成数 =価電子 + 一価原子 + (負電荷) – (正電荷)/2
=7+ 2 + 1- 0/2 =10/2 =5
ハイブリダイゼーション数が 5 の場合、ハイブリダイゼーションは sp3d です。
VSEPR (原子価殻電子対反発) 理論によれば、混成数は結合対と非共有電子対の和で計算できます。 I3- では、I の周りの結合ペアの数は 2 で、非共有ペアの数は 3 です。したがって、非共有ペアと結合ペアの合計は 2 + 3 =5 であり、これが sp3d ハイブリダイゼーションです。 sp3d ハイブリダイゼーションの場合、5 つの結合ペアが存在する場合、予想されるジオメトリは三方両錐体ジオメトリです。三ヨウ化物イオンには、結合対だけでなく孤立電子対もあります。 VSEPR 理論によると、原子価殻に存在する電子対は反発を受けます。反発は、結合ペア、孤立ペア、および孤立ペア-結合ペアの間で発生する可能性があります。結合間の反発力は弱く、結合が遠くに移動するにつれて結合角度が増加することがあります。孤立電子対間の反発が強く、結合角が減少します。孤立ペア間の反発は強いですが、孤立ペア - 孤立ペアの反発よりも弱いです。反発の順番は
結合対 - 結合対反発<孤立対 - 結合対反発 <孤立対 - 孤立対反発
三ヨウ化物イオンには、孤立電子対孤立電子対反発、孤立電子対結合対反発、結合電子対結合電子反発があります。そのため、分子は元のジオメトリ、形状、および結合角から逸脱します。予想されるジオメトリは三角両錐であり、得られる形状は線形です。 sp3d ハイブリダイゼーションの予想される結合角は 120 と 90 ですが、線形の形状のため、その結合角は 180 です。
結論
イオン結合は、電子を失うか電子を獲得することによって、つまり電子の移動によって元素が結合するときに起こる結合です。このタイプの結合は、電気陰性度の異なる元素間、または金属と非金属の間で発生します。電気陰性度がほぼ同じ、または電気陰性度の差が小さい元素は、電子を共有することで共有結合を形成します。