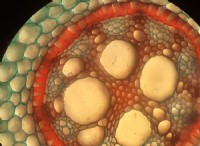
原子半径は、原子核から原子の最も外側の軌道までの距離です。円の半径に例えると、その概念を理解できます。ここでは円の中心が核です。原子半径には、共有結合半径、金属半径、イオン半径の 3 種類があります。 2 つの類似した原子間に共有結合が存在するとします。次に、共有結合半径は、共有結合している 2 つの類似した原子間の単結合の長さの半分です。
共有結合
ラングミュア (1919) 共有結合を導入することにより、ルイスの仮説を再定義しました。彼によると、2 つの原子が 1 組の電子を共有する場合、それらは共有結合になります。それらが複数の電子対をペアリングしている場合、それらは二重または三重の共有結合になる可能性があります。共有結合が形成されると、共有結合半径も取得できます。
共有結合半径の概要
理論によると、核と外殻の間の距離は、共有結合した原子の 2 つの核の間の距離の半分になると想定しています。これは、原子核が電子に対して等しい引力を持つという考えに基づいています。したがって、同じ数の電子を持つ 2 つの類似した原子間で結合が形成される場合、原子半径は原子核間の距離の半分になります。その場合、2 つの原子核間の距離が原子の直径になります。 「共有結合半径は原子の大きさの尺度です」と言うのはそのためです。
電子はほとんど目に見えず小さいので、結合した状態の原子間の距離から原子の大きさを計算することができます。 X 線技術は、結合長として知られる 2 つの原子核間のこの距離を測定します。
たとえば、塩素分子 (Cl2 ) の結合距離は 198 pm で、この距離の半分 (99 pm) を塩素の原子半径とします。
共有分子 AB の結合長は、
として表すことができます。R=rA +rB (ここで、R は結合長、rA と rB はそれぞれ原子 A と B の共有結合半径)
周期表における原子半径と傾向
原子半径は、原子内の核と原子価殻の間の距離であり、共有結合、金属結合、またはイオン結合の可能性があります。
- 周期表の左から右に移動すると、原子半径が減少し、原子核と電子の間の引力が増加します。これにより、原子サイズが小さくなります。
- グループを下に移動すると、原子半径は 2 つの理由で増加します。
周期表における共有結合半径と傾向
原子半径と同様に、
- 左から右に移動すると、核電荷が大きくなるため共有結合半径が減少し、電子が原子核に引き寄せられます。
- 共有結合半径は、電子で占有された殻の数が増加するため、グループの下に増加します.
共有結合半径の注意
共有結合半径は X 線回折を使用して測定され、回転分光法はより正確な結合長の値を示します。分子結晶に中性子回折を使用することはめったにありません。
通常、 ピコメートル (pm) またはオングストローム (Å) で測定されます。
2 つの原子間の共有結合半径の合計は、それらの 2 つの原子間の共有結合の長さに等しいと仮定します。しかし、環境が異なれば原子サイズが異なる可能性があるため、実際には不可能です。したがって、共有結合の長さも異なります。これは、極性共有結合の短さの現象を説明しています.
集計された共有半径は、何千もの実験データから作成されます。しかし、それらは理想化された値または平均化された値にすぎません。
結論
原子半径は、原子内の原子核と原子価殻の間の距離であり、共有結合、金属結合、またはイオン結合のいずれかです。共有結合半径は、共有結合している 2 つの類似した原子間の単結合の長さの半分です。共有結合半径は、X 線回折を使用して測定されます。
2 つの原子間の共有結合半径の合計は、それらの 2 つの原子間の共有結合の長さに等しいはずです。しかし、環境が異なれば原子サイズが異なる可能性があるため、実際には不可能です。したがって、共有結合の長さも異なり、原子サイズの測定が中断されます。