C2H4 は、エチレンとして知られる無色で可燃性のガスの化学式です。 2つの炭素原子が二重結合で結合した炭化水素と言われています。空気より軽いです。 C2H4 は sp² ハイブリダイゼーションの例で、s 軌道が 1 つ、p 軌道が 2 つ混ざって sp² 軌道が 3 つになります。ここでは、1 つの 2p 軌道は変化せず、パイ結合を形成するのに役立ちます。 sp² 炭素原子のそれぞれは、三角形の平面形状と、結合間の角度が 120° になっています。 VSEPR 理論によると、C2H4 の分子構造と電子構造は同じです。つまり、三方平面です。
C2H4 分子構造の重要性
分子構造は、分子またはイオン内の原子の配置を定義します。 C2H4 の場合、分子内の各炭素が sp² ハイブリダイゼーションを起こし、2 つの水素によって構造が 2 次元の三角形平面のように見えます。炭素に結合した水素の結合対は互いに反発し、その結果、形成される図形は三角平面になります。ルイス構造は、分子が構成する孤立電子対と結合対の数をルイス図が決定するため、C2H4 分子の幾何学を見つけるのに役立ちます。
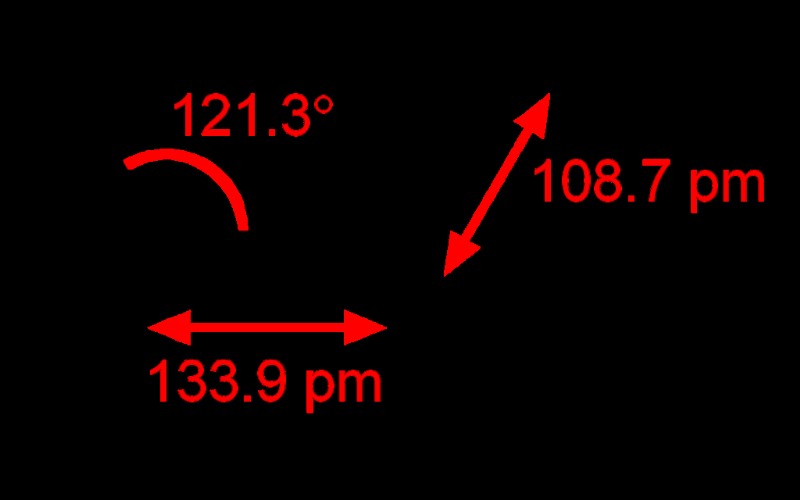
A-X-N 法は、C2H4 の分子構造と結合角を見つけることができます。ここで、中心原子は「A」で表されます。この場合、A=1 です。中心原子に結合している原子の数は「X」で示されます。ここでは、2 つの炭素原子が結合しており、両方の原子に 2 つの水素原子が結合しています。 「N」は中心原子に結合した孤立電子対の数を示し、C2H4 には孤立電子対がなく、N=0 を意味します。したがって、A-X-N 法によって C2H4 分子の AX3 を得ました。分子には孤立電子対がないため、N は無視できます。AX3 は、C2H4 の形状を 120 度の結合角を持つ三角平面として定義します。
C2H4 分子構造に関する質問
C2H4 の分子構造と結合角を調べる方法
C2H4 の分子構造と結合角を見つけるための 3 つのステップは次のとおりです:
1.まず、C2H4 の中心原子が持つ非共有電子対の数を見つけます。
孤立したペアの別の用語は、共有されていないペアです。 C2H4 のルイス構造によると、中心原子に孤立電子対が存在しないことがわかります。
孤立したペアの確認に式を使用することもできます.
L.P =(V.E – N.A)/2
L.P は中心原子の孤立電子対を表し、V.E は特定の中心原子の価電子を表し、N.A は中心原子に結合した原子の数を表します。
炭素の価電子 =4。炭素原子に結合している原子 =4
したがって、ローン ペア =(4 – 4)/2.そのため、分子には孤立電子対がないことがわかりました。
2. C2H4 のハイブリダイゼーションを調べる
C2H4 の分子構造を決定するには、C2H4 のハイブリダイゼーションを調べる必要があります。ハイブリダイゼーションを見つける式は次のとおりです。- H =N.A. =L.P.
H はハイブリダイゼーションを表し、N.A. は中心原子に結合した原子の数を表し、L.P. はその特定の原子上の孤立電子対を表します。 C2H4 のルイスドット構造を見ると、炭素が分子の中心原子であり、各炭素原子が 3 つの原子、つまり 1 つの炭素原子と 2 つの水素原子と結合していることがわかります。前のステップで孤立電子対が 0 であることがわかったので、この式でその情報を使用します。
H =3 + 0
ハイブリダイゼーションの数は 3 で、sp² ハイブリダイゼーションです。
結論
エチレンは空気より軽い無色の気体で、水にも溶けます。エチレンの化学式は C2H4 で、これは 2 つの炭素原子と 4 つの水素原子があることを意味します。 2つの炭素原子は互いに結合しており、各原子は2つの水素原子に結合しています。 C2H4 の分子構造は三角平面であり、その電子構造も同じです。結合間の角度は 120° です。また、2 つの炭素二重結合の自由な回転が制限されます。分子に含まれる結合対と孤立電子対の数を定義するルイスの構造を利用して、分子の幾何学を調べることができます。