主な違い – 極性結合と非極性結合
極性結合と非極性結合はどちらも、原子間の共有結合の 2 つのタイプです。共有結合では、電子は、電子を完全に与えたり受け入れたりするのではなく、関係する 2 つの原子種間で共有されます。ただし、関係する原子の種類によっては、共有電子対が常に結合の中心にあるとは限りません。一部の元素は、他の元素よりも電子に対して高い親和性を持っています。したがって、結合内の電子は、電子に対してより高い親和性を持つ要素に向かって引き付けられる傾向があります。その結果、結合は電子の位置に関して不均衡を示します。この現象は「極性」と呼ばれます 」。この性質を示す結合は極性結合であり、電子が結合のどちらの側にも偏ることなく中央に存在する結合は、非極性結合と呼ばれます。したがって、主な違い 極性結合と非極性結合の間は、極性結合は異なる電気陰性度を持つ要素間で発生します 一方、同じ電気陰性度の間で非極性結合が発生します。
極性結合とは
極性結合は、電気陰性度が互いに異なる場合に 2 つの要素間に発生する共有結合の一種です。電気陰性度という用語は、電子に対する親和性を指します。電気陰性度の高い原子は、電気陰性度の低い原子よりも電子を引き付ける傾向があります。フッ素は最も電気陰性度の高い元素として知られています。
2 つの原子間に共有結合が形成されると、それらの間で電子が共有され、これらの共有された電子は通常、結合に関与する 2 つの原子の間の空間内に存在します。これは多かれ少なかれ電子雲に似ています。したがって、ある元素が他の元素よりも電子を引き付ける傾向がある場合、電子雲の密度は、電子親和力の高い元素に向かってシフトします。これにより、電子分布が歪んでしまいます。
その結果、結合のいずれかの角に軽い電荷が形成され、電気陰性度が高い末端に負電荷が、反対側に相補的な正電荷が形成されます。それぞれ。これらの分極結合は、「H 結合」などの強力な分子間相互作用を形成することができます。分極結合には「双極子モーメント」が含まれていると言われ、結合に関与する各要素は「双極子」と呼ばれます。ただし、分極結合が極性化合物の形成につながるとは限りません。これは、結合が原子内でどのように配向されているかによって異なります。双極子力が相殺されるようなものであれば、化合物が極性結合を持っていても、化合物自体は極性化合物とは呼ばれません.
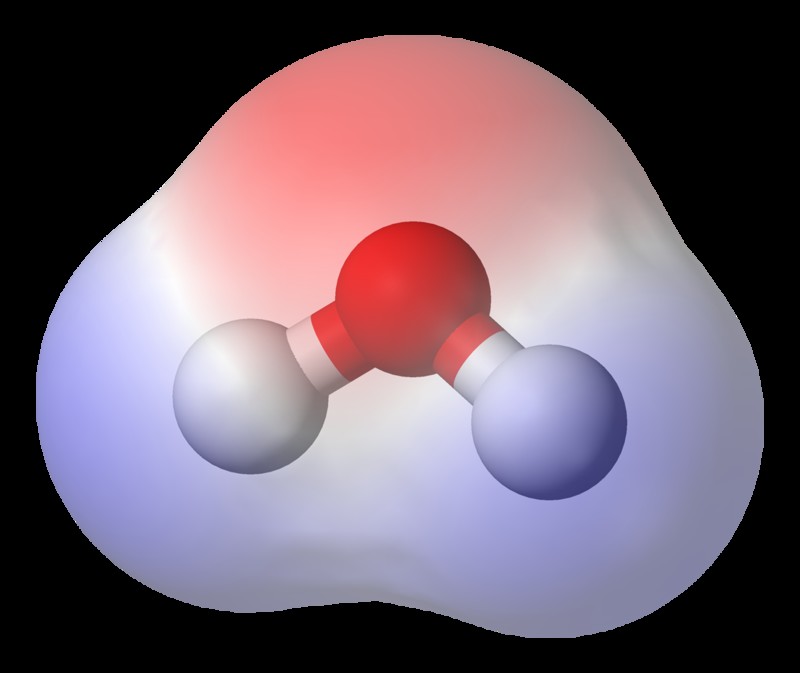
水分子 (負の電荷は赤でシェーディングされています。)
非極性結合とは
これらは、電気陰性度が同じ場合に 2 つの要素間に発生する一種の共有結合です。したがって、通常、結合に関与する原子が類似している場合、無極性結合が発生します。これらのタイプの化合物は「二原子化合物」と呼ばれます。この場合、共有される電子は、バランスの取れた/集中化された電子雲を維持しながら、結合面の中心に存在する傾向があります。したがって、雲に歪みは見られません。
極に電荷が蓄積することもなく、結合は中立のままです。ただし、電子雲の瞬間的な動きにより、極に瞬間的な変化が生じる可能性があり、これらはファンデルワールス相互作用などの非極性化合物間の分子間引力を引き起こします。一般に、非極性結合を含むすべての化合物は非極性化合物です。

エタン
極性結合と非極性結合の違い
定義
極性結合 異なる電気陰性度を持つ要素間の共有結合です。
非極性結合 同じ電気陰性度を持つ要素間の共有結合、つまり類似した原子間の共有結合です。
電子雲の性質
極性結合の電子雲
無極性結合の電子雲 は歪んでいません。
荷電柱
極性結合 極に電荷が蓄積されています。
無極性結合 そのような料金は発生しません。
双極子モーメント
極性結合 双極子モーメントがあります。
無極性結合 双極子モーメントはありません。
分子間相互作用
極性結合の荷電極間に H 結合が発生します。
ファン デル ワールス相互作用は非極性間でよく見られます 化合物。 
画像提供:
「Water-elpot-transparent-3D-balls」。 (パブリック ドメイン) Commons 経由
Ben Mills による「Ethane-A-3D-balls」 – 自作。 (パブリック ドメイン) ウィキメディア コモンズ経由







