主な違い – アルファ ヘリックスとベータ プリーツ シート
アルファ ヘリックスとベータ プレートは、タンパク質の 2 つの異なる二次構造です。アルファヘリックスは、ポリペプチド鎖の右巻きコイル状またはらせん構造です。アルファヘリックスでは、すべてのバックボーン N-H グループが、バックボーン C=O グループに水素結合を提供します。これは、前の 4 つの残基に配置されます。ここでは、らせん構造を作成するために、水素結合がポリペプチド鎖内に現れます。ベータ シートは、少なくとも 2 つまたは 3 つの主鎖水素結合によって横方向に接続されたベータ鎖で構成されます。それらは、一般的にねじれたプリーツシートを形成します。 アルファヘリックスとは対照的に 、ベータ シートの水素結合は、1 つの鎖のバックボーンの N-H グループと隣接するストランドのバックボーンの C=O グループの間に形成されます .これが主な違いです Alpha Helix と Beta プリーツ シートの間。
アルファ ヘリックスとは
タンパク質はポリペプチド鎖で構成されており、ポリペプチド鎖の折り畳みの形状に応じて、一次、二次、三次、四次などのいくつかのカテゴリに分類されます. α ヘリックスと β プリーツ シートは、ポリペプチド鎖の 2 つの最も一般的に見られる二次構造です。
タンパク質のアルファヘリックス構造は、主鎖のアミド基とカルボニル基の間の水素結合によって形成されます。これは右巻きのコイルで、通常、ポリペプチド鎖に 4 ~ 40 個のアミノ酸残基が含まれています。次の図は、アルファヘリックスの構造を示しています。
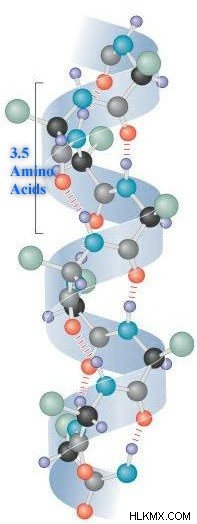
あるアミノ残基のN-H基と別のアミノ酸のC=O基との間に水素結合が形成され、4残基前に配置されます。これらの水素結合は、アルファ ヘリックス構造を作成するために不可欠であり、ヘリックスのすべての完全なターンには 3.6 のアミノ残基があります。
R 基が大きすぎるアミノ酸 (トリプトファン、チロシンなど) または小さすぎるアミノ酸 (グリシンなど) は、α ヘリックスを不安定にします。プロリンはまた、その不規則な形状のためにαヘリックスを不安定にします。その R 基はアミド基の窒素に結合し、立体障害を引き起こします。さらに、プロリンの窒素に水素がないため、水素結合に参加できません。それとは別に、アルファヘリックスの安定性は、水素結合に関与する C=O グループの個々の双極子によって引き起こされる、ヘリックス全体の双極子モーメントに依存します。安定したαヘリックスは通常、荷電したアミノ酸で終わり、双極子モーメントを中和します。
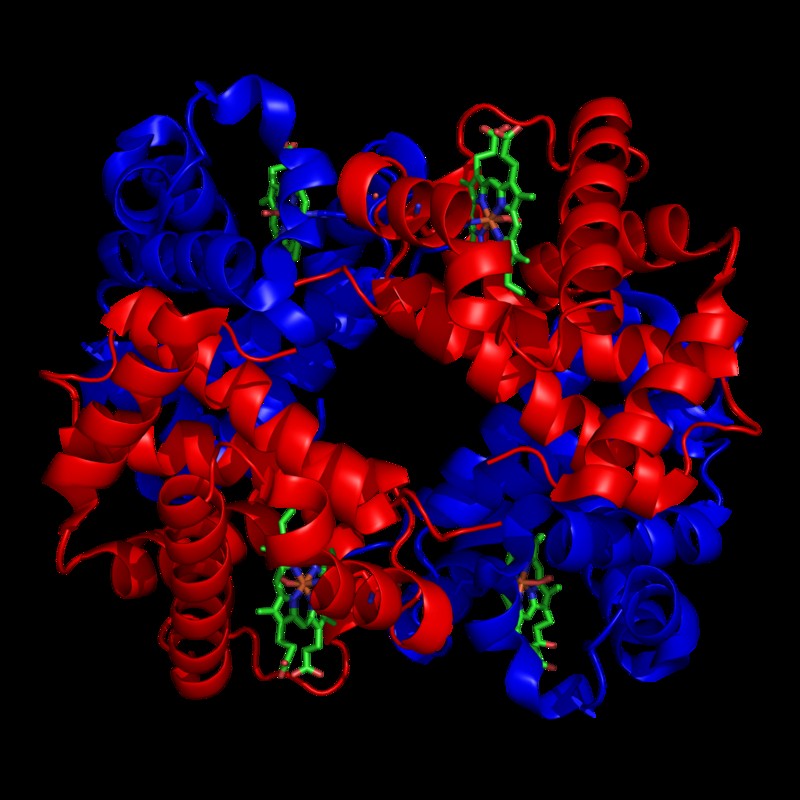
4 つのヘム結合サブユニットを持つヘモグロビン分子で、それぞれが主に α ヘリックスで構成されています。
ベータ プリーツ シートとは
ベータ プリーツ シートは、別のタイプのタンパク質二次構造です。ベータ シートは、少なくとも 2 つまたは 3 つの主鎖水素結合によって横方向に接続されたベータ ストランドで構成され、一般にねじれたプリーツ シートを形成します。通常、β鎖は3~10個のアミノ酸残基を含み、これらの鎖は広範な水素結合ネットワークを形成しながら他のβ鎖と隣接して配置されます。ここで、1 つの鎖の主鎖にある N-H 基は、隣接する鎖の主鎖にある C=O 基と 水素結合 を作成します。方向を説明するために、ペプチド鎖の 2 つの末端を N 末端と C 末端に割り当てることができます。 N末端は、遊離アミン基が利用できるペプチド鎖の一端を示します。同様に、C 末端はペプチド鎖のもう一方の末端を表し、遊離のカルボキシル基が利用可能です。
隣接するβストランドは、逆平行、平行、または混合配置で水素結合を形成できます。逆平行配列では、1つのスタンドのN末端が次のスタンドのC末端に隣接する。平行配置では、隣接する鎖のN末端が同じ方向に向いています。次の図は、平行および逆平行ベータ鎖の構造と水素結合パターンを示しています。
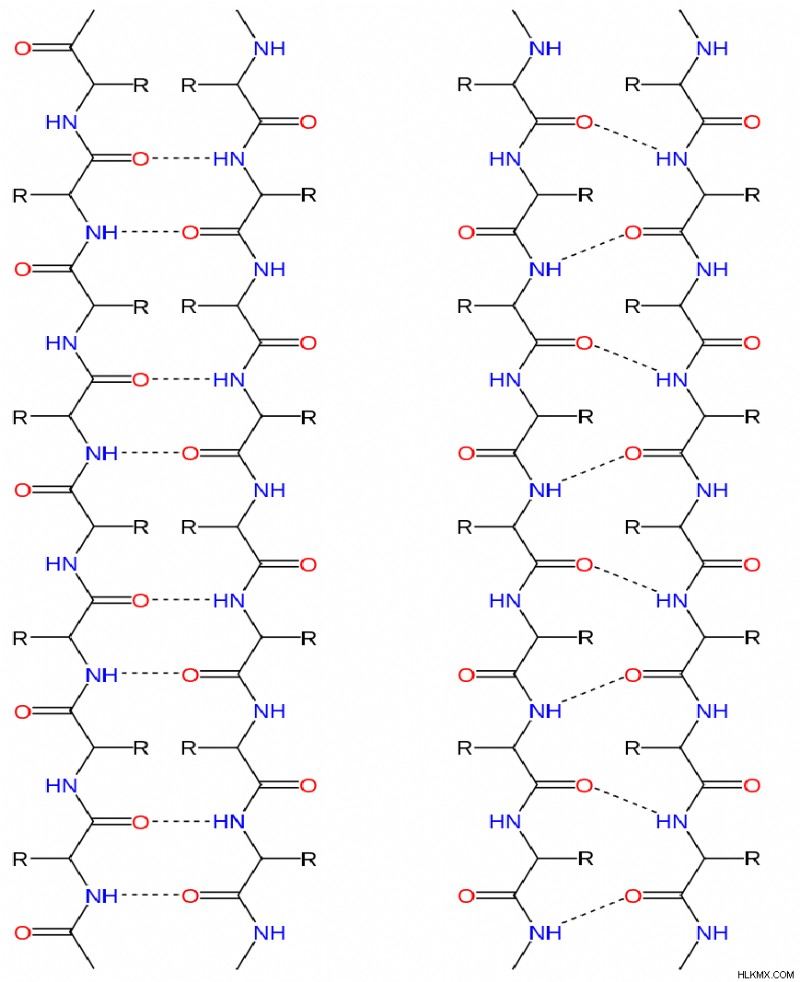
a) 逆平行
b) 並行
アルファヘリックスとベータプリーツシートの違い
形状
アルファヘリックス: Alpha Helix は右巻きのコイル状の棒のような構造です。
ベータ プリーツ シート: ベータシートはシート状の構造です。
フォーメーション
アルファらせん: らせん構造を作成するために、ポリペプチド鎖内で水素結合が形成されます。
ベータ プリーツ シート: ベータ シートは、H 結合によって 2 つ以上のベータ ストランドを結合することによって形成されます。
債券
アルファらせん: アルファヘリックスは、n + 4 の水素結合スキームを持っています。すなわち、1 つのアミノ残基の N-H 基と別のアミノ酸の C=O 基との間に水素結合が形成され、4 残基前に配置されます。
ベータ プリーツ シート: 水素結合は、隣接するペプチド鎖の隣接する N-H 基と C=O 基の間に形成されます。
-R グループ
アルファらせん: -アミノ酸のR基はヘリックスの外側に向いています.
ベータ プリーツ シート: -R基は、シートの内側と外側の両方に向けられています。
番号
アルファらせん: これは 1 つのチェーンにすることができます。
ベータ プリーツ シート: これは、単一のベータ ストランドとして存在することはできません。 2 つ以上ある必要があります。
タイプ
アルファヘリックス: これには 1 つのタイプしかありません。
ベータ プリーツ シート: これは、並列、逆並列、または混合のいずれかです。
資質
アルファヘリックス: 100 回転、1 ターンあたり 3.6 残基、1 つのアルファ炭素から 2 番目のアルファ炭素への 1.5 A 上昇
ベータ プリーツ シート: 3.5 残基間の上昇
アミノ酸
アルファらせん: アルファヘリックスは、ヘリックスのコアにある主鎖の水素結合をカバーして保護できるアミノ酸側鎖を好みます。
ベータ プリーツ シート: 拡張された構造により、アミノ酸側鎖に最大の空きスペースが残されます。したがって、大きなかさ高い側鎖を持つアミノ酸は、ベータ シート構造を好みます。
好み
アルファらせん: アルファヘリックスは、Ala、Leu、Met、Phe、Glu、Gln、His、Lys、Arg アミノ酸を好みます。
ベータ プリーツ シート: ベータシートは、Tyr、Trp、(Phe、Met)、Ile、Val、Thr、Cys を好みます。