主な違い - 自発的な反応と非自発的な反応
自然反応と非自然反応は、環境で発生する 2 種類の化学反応です。自発的な反応は、特定の条件下で自然に発生します。ただし、非自発的反応が進行するためにはエネルギーが必要です。ギブスの自由エネルギーの変化は、自発的な反応に対して負です。したがって、これらの反応は熱の形で周囲にエネルギーを放出します。非自発的反応では、ギブス自由エネルギーの変化は正です。それらは環境からエネルギーを吸収します。そのため、自発的な反応は発エルゴン的であり、非自発的な反応は吸エルゴン的です。 主な違い 自発的な反応と非自発的な反応の違いは、自発的な反応がシステムから自由エネルギーを放出し、システムをより安定させるのに対し、非自発的な反応はシステムの総エネルギーを増加させることです。 .
対象となる主な分野
1.自然反応とは
– 定義、熱力学、例
2.非自発的反応とは
– 定義、熱力学、例
3.自発的反応と非自発的反応の類似点は何ですか
– 共通機能の概要
4.自発的反応と非自発的反応の違いは何ですか
– 主な相違点の比較
重要な用語:吸エルゴン反応、エントロピー、発エルゴン反応、ギブズ自由エネルギー、非自発的反応、自発的反応

自発的な反応とは
自発的な反応とは、外部の力によって駆動されることなく発生する化学反応を指します。化学反応の 2 つの原動力は、エンタルピーとエントロピーです。エンタルピーは、システムの圧力と体積の積に追加された内部エネルギーの合計であるシステムの熱力学的特性です。エントロピーは、単位温度あたりのシステムの熱エネルギーを説明するもう 1 つの熱力学的特性です。分子のランダム性と無秩序性について説明します。化学反応の発生によりエンタルピーが減少し、システムのエントロピーが増加する場合、それは好ましい反応と見なされます。自発的な反応は上記の 2 つの条件を満たすため、内部の介入なしに発生します。

図 1:木材の燃焼
燃焼は自然反応の一例です。火の生成物の一部は、二酸化炭素と水蒸気の 2 つのガスで構成されています。燃焼により熱が発生します。したがって、それは発エルゴン反応です。熱は系のエントロピーを増加させます。しかし、燃焼生成物のエントロピーは減少したエントロピーを持っています.
非自発的反応とは
非自発的反応とは、進行するためにエネルギー入力を必要とする化学反応を指します。非自発的反応では、エンタルピーとエントロピーの両方が反応物を優先します。したがって、反応物は生成物よりも安定しています。そのため、化学反応は吸エルゴン的で、熱を吸収します。エントロピーも減少します。非自発的反応における時間の経過に伴うギブズ自由エネルギーの変化を 図 2 に示します。
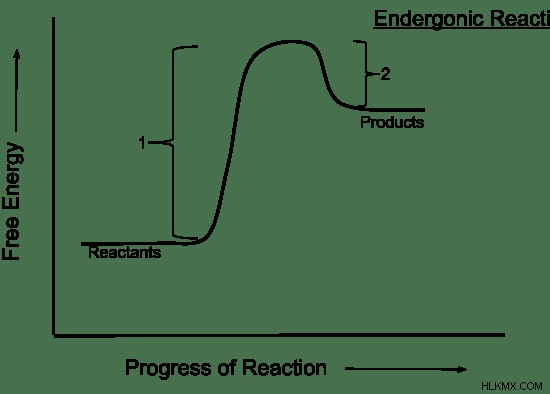
図 2:ギブズの自由エネルギー/時間の変化
大気中の窒素と酸素の間の反応は、非自発的反応の一例です。それは一酸化窒素を形成します。通常の大気圧と温度では、この反応は好ましくありません。これは、化学反応の反応物、つまり窒素ガスと酸素ガスが、生成物である一酸化窒素よりも安定していることを意味します。しかし、雷のような非常に高い温度では、この反応は有利です.
自発的反応と非自発的反応の類似点
- 環境では、自発的な反応と非自発的な反応の両方が発生します。
- 自発的な反応と非自発的な反応の両方が、定義された境界を持つシステムで発生します。
- 自然反応と非自然反応の両方が、熱力学の 3 つの法則に従います。
自発的な反応と非自発的な反応の違い
定義
自発的な反応: 自発的な反応とは、外部の力によって駆動されることなく発生する化学反応を指します。
非自発的な反応: 非自発的反応とは、進行するためにエネルギー入力を必要とする化学反応を指します。
有利/不利
自発的な反応: 自発的な反応は好意的です。
非自発的な反応: 非自発的な反応は好ましくありません。
エネルギー入力
自発的な反応: 自発的な反応は、一連の条件下で進行するためにエネルギー入力を必要としません。
非自発的な反応: 非自発的な反応が進行するにはエネルギー入力が必要です。
ギブスの自由エネルギーの変化
自発的な反応: 自発的な反応におけるギブスの自由エネルギーの変化は負です (ΔG° <0).
非自発的な反応: 非自発的反応におけるギブズ自由エネルギーの変化は正です (ΔG°> 0).
システムの総エネルギー
自発的な反応: 自発的な反応はシステムから自由エネルギーを放出し、システムをより安定させます。
非自発的な反応: 非自発的な反応は、システムの総エネルギーを増加させます。
製品の総エネルギー
自発的な反応: 自発的な反応の生成物の総エネルギーは、反応物の総エネルギーよりも小さくなります。
非自発的な反応: 非自発的反応の生成物の総エネルギーは、反応物の総エネルギーよりも高くなります。
エンタルピー
自発的な反応: 自然反応のエンタルピーは負です。
非自発的な反応: 非自発的反応のエンタルピーは正です。
発エルゴン/吸エルゴン反応
自発的な反応: 自然反応は発エルゴン反応です。
非自発的な反応: 非自発的反応は吸エルゴン反応です。
エントロピー
自発的な反応: 自発的な反応はエントロピーを増加させます。
非自発的な反応: 非自発的反応はエントロピーを減少させます。
反応の速さ
自発的な反応: 自発的な反応が急速に起こります。
非自発的な反応: 非自発的な反応は速度が遅くなります。
例
自発的な反応: 燃焼反応は自発的です。
非自発的な反応: 大気中の窒素と酸素の間の反応は、非自発的反応の一例です。
結論
自然反応と非自然反応は、環境内で起こる 2 種類の化学反応です。自発的な反応は発エルゴン的です。したがって、それらはエンタルピーを減少させ、システムのエントロピーを増加させます。しかし、非自発的反応は吸エルゴン的です。それらは、進行するために外部エネルギー入力を必要とするため、システムのエンタルピーを増加させます。また、エントロピーも減少します。そのため、自発的な反応は、特定の一連の化学反応の下で有利です。しかし、非自発的な反応は好ましくありません。自発的反応と非自発的反応の主な違いは、各タイプの反応の熱力学的特性です。
参照:
1.「熱力学の法則」。熱力学の法則 |無限の化学、ここから入手できます。
2. 「11.5:自然反応と自由エネルギー」 Chemistry LibreTexts、Libretexts、2017 年 11 月 1 日、こちらから入手できます。
3. 「エンダーゴン反応」。ウィキペディア、ウィキメディア財団、2017 年 12 月 16 日、こちらから入手可能。
画像提供:
1. Fir0002 による「大かがり火」 – 元々は著者 (CC BY-SA 3.0) がコモンズ ウィキメディア経由で英語版ウィキペディアにアップロードしたもの
2. Provenzano15による「Endergonic Reaction」–コモンズウィキメディア経由の自身の作品(CC BY-SA 3.0)







