主な違い - モルと分子
モルと分子は、化学で使用される 2 つの異なる用語です。モルという用語は、グラムやミリグラムなどの単位では測定できない量を表すために使用されます。したがって、モルは原子、イオン、または分子の数を測定します。分子は、化学結合によっていくつかの原子が結合することによって形成される化学種です。分子には電荷がありません。分子を構成する原子は、同じ元素であっても異なる元素であってもかまいません。これらの原子間の比率は、分子ごとに異なります。システムに存在する分子の数は、モルで測定できます。モルと分子の主な違いは、モルは量の測定単位であるのに対し、分子は原子から構成される化学種であることです。
対象となる主な分野
1.モグラとは
– 定義、歴史的背景、アプリケーション
2.分子とは
– 定義、種類、用途
3.分子と分子の違いは何ですか
– 主な相違点の比較
重要な用語:原子、アボガドロ数、イオン、分子、分子
モグラとは
1 モルは、12.0 g の C 同位体に存在する原子の数と同じ数の量です。モルの値は 6.023 x 10 として与えられます。この値はアボガドロ数と呼ばれます。つまり、12.0 g の C 同位体は 6.023 x 10 個の炭素原子で構成されています。言い換えると、1 モルの炭素は 1 アボガドロ数の炭素原子で構成されています。
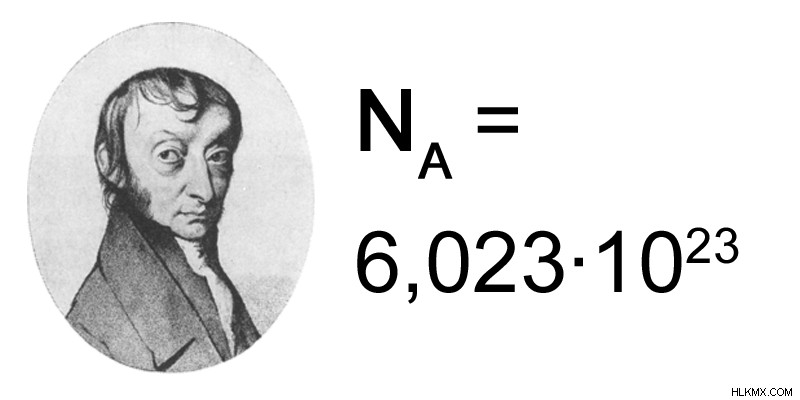
図 1:アボガドロ数
モル数は、単位「モル」で指定できます。モルという用語は、原子、分子、イオンなどの任意の化学種で使用できます。したがって、1 モルの硫黄は 1 モルの硫黄原子を意味します。二酸化炭素 1 モルは、1 モルの CO
原子レベルになると、グラムやミリグラムなどの単位は、非常に小さな量を測定する必要があるため、あまり役に立ちません。 1805 年、ジョン・ダルトンは、水素に関する各元素の原子量から構成される最初の標準原子量表を思いつきました。水素の原子量は 1 とした。したがって、これらは相対原子量である。その後、原子論の発展とともに、ドイツの科学者ヴィルヘルム・オストワルドによってモルの概念が導入されました。それ以来、モルは「mol」で表される SI の基本単位になりました。
モルは、化学反応で一般的に使用される用語です。一定量の反応物によって得られる生成物の量は、化学反応の反応物と生成物のモル比を決定することによって予測できます。原子量は、その元素の 1 モルの質量として与えられます。そうでなければ、原子の重さは非常に微小な値であるため、扱いが非常に困難です。
たとえば、
酸素原子 1 個の重さ =2.6 x 10 kg。
1モルの酸素は6.023 x 10酸素原子で構成されています
1モルの酸素=(2.6 x 10 x 6.023 x 10)
=15.9 gの重量
酸素の原子量 =15.9 g/mol.
15.99 (約 16) のような値を扱うのは、2.6 x 10 g を扱うよりも簡単です。したがって、ほくろの概念は研究において非常に重要です。
分子とは
分子は、化学結合による複数の原子の組み合わせによって形成される化学種です。これらの結合は、共有結合、イオン結合、または配位結合である可能性があります。これらの原子の組み合わせは、同じ元素または異なる元素の原子を含み得る。さらに、分子内のこれらの原子間の比率は、その分子に固有です。組み合わせを変えると新しい分子になります。たとえば、O2 分子、O3 も分子です。しかし、それらは異なる分子です。
単一の原子は分子ではありません。化合物は、いくつかの異なる元素から作られた分子です。したがって、一部の分子は H
図 2:分子は、単純な分子または複雑な分子として見つけることができます。
上の画像は、共有結合を介して互いに結合した多数の原子で構成される複雑な分子を示しています。
分子は、二原子分子、三原子分子などとして見つけることができます。分子には、イオン結合または共有結合がある場合があります。たとえば、NaCl分子は、Na原子とCl原子の間にイオン結合を持っています。 SO3 分子は、中央の硫黄原子と酸素原子の間に共有結合を持っています。 NH3 のような化合物 BF3 、共有結合および配位結合が存在します。ただし、これらはすべて分子です。
Mole と Molecule の違い
定義
ほくろ: 1 モルは、12.0 g の C 同位体に存在する同じ数の原子を持つものの量です。
分子: 分子は、化学結合による複数の原子の組み合わせによって形成される化学種です。
アプリケーション
ほくろ: モルは、物質の量を測定するために使用されます。
分子: Molecule は、複数の原子の組み合わせに名前を付けるために使用されます。
ユニット
ほくろ: モルは単位「mol」で与えられます。
分子: 分子の数は、存在する「mol」の数として測定できます。
結論
モルと分子という 2 つの用語は異なる用語ですが、モルの概念を使用して、サンプルに存在する分子の量を測定できます。モルと分子の主な違いは、モルは量の測定単位であるのに対し、分子は原子から作られる化学種であることです.