コア コンセプト
このチュートリアルでは、酸化、還元、ガルバニ電池、電気化学の応用など、電気化学の基礎を学びます。また、基本的な電気化学方程式とその使用方法についても説明します。
電気化学は、化学反応と電気の関係を研究する分野です。これには、電池のように電気を生成する化学反応、電気を必要とする化学反応などが含まれます。
他の記事で取り上げるトピック
- 電気化学セル
- レドックス反応を理解する
- レドックス反応のバランスを取る方法
- 平衡定数とは?
- 正味のイオン方程式の書き方
語彙
酸化 :原子が電子を失うプロセス
削減 :原子が電子を獲得するプロセス
酸化還元反応 :酸化と還元が起こる化学反応。つまり、化学種間で電子が移動します。
クーロン :電荷のSI単位(略称C)
電圧 (別名 ポテンシャル ):電荷によって運ばれるエネルギー (ジュール/クーロンの単位)
レドックス反応
ほとんどの化学反応は、電子の観点からは非常に単純です。結合は形成または切断される可能性がありますが、通常、すべての原子は電子をそのまま保持します。これは、酸化還元反応には当てはまりません。 「レドックス」は「還元」と「酸化」を組み合わせたものです。酸化還元反応は、電子が原子または分子によって失われ、他のものに移動する反応です。この電子の移動は、電気化学の核心です。レドックス反応とそれらのバランスをとる方法の詳細については、リンクされたチュートリアルを参照してください。
レドックス反応の例
2Na (s) + 2H2 O (l) → 2NaOH (aq) + H2 (g)
Fe (aq) + Ag (aq) → Fe (aq) + Ag (s)
2Al (s) + 6H (aq) → 2Al (aq) + 3H2 (g)
半反応
酸化還元反応が還元と酸化の半反応に分割されると、電子はそれぞれ生成物と反応物として書き込まれます。それらは、一緒に「追加」されると、全体的な酸化還元反応を行うため、半反応と呼ばれます。多くの場合、半反応は独立して考えられます。
ガルバニ電池
ガルバニ電池は、電流を生成する制御された特定の方法で酸化還元反応を促進するセットアップです (電子の流れ)。ボルタ電池、電気化学電池、およびバッテリーはすべて、ガルバニ電池の異なる名前です。こちらのガルバニ電池に関する詳細なチュートリアルをご覧ください。
ボルタ電池図
以下は、典型的なボルタ電池を示す図です。
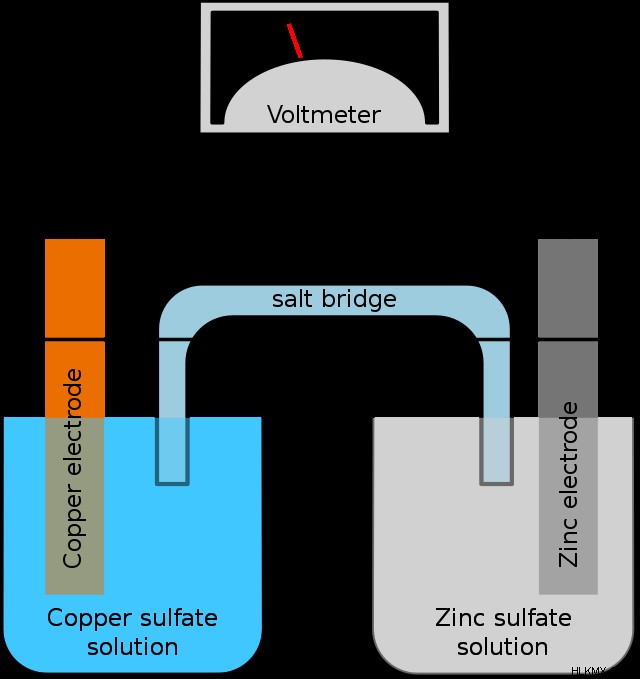
図を分解して、セルの各部分を見ていきましょう。
まず、還元ハーフセルと呼ばれるセルの「銅側」 .ボルタ電池全体の半分を構成し、電子が流れる場所であるため、これと呼ばれます(そこで還元が行われることを意味します)。入ってくる電子は溶液中の銅イオンを還元して銅金属を形成し、銅電極の表面に堆積します。
次に、セルの「亜鉛側」は酸化ハーフセルと呼ばれます .亜鉛が電子を放出(酸化)しているため、これと呼ばれます。電子が電極内の亜鉛金属を離れると、それらはワイヤ上を還元半電池に流れ、残りの亜鉛イオンが溶液に入ります.
2 つの半電池を接続するワイヤが、電子の流れを可能にします。ワイヤがなければ、電気化学反応を進行させるものがないため、このセットアップは何もしません。ワイヤーには通常、電圧計が含まれています。 セルの電圧を測定する装置。
最後に、ガルバニ電池の縁の下の力持ちである塩橋です。これには、反応が進行するにつれて形成される電荷の蓄積を相殺するスペクテーター イオン塩が含まれています。電子が流れると、正に帯電した亜鉛イオンが一方のセルで形成され、正に帯電した銅イオンが他方のセルから離れます。アンバランスな電荷は極度です 化学的に好ましくなく、そのため、電荷のバランスをとる何かがなければ反応は進行しません.塩橋はまさにこれを行い、正イオンを還元半電池に、負イオンを酸化半電池に供給します。塩橋がなければ、ガルバニ電池は機能しません。
自発性と均衡
熱力学から、いくつかのプロセスは自発的であるか、エネルギーの入力なしで発生することを思い出すかもしれません。システムのギブズ自由エネルギーの変化である ΔG (「デルタ G」) は、自発性を表します。 ΔG が負の場合、システムのエネルギーは低下しています (有利)。 ΔG が正の場合、システムのエネルギーは上昇しています (有利ではありません)。
電気化学者はΔGをあまり使用しません。これは、レドックスシステムの電圧が同じこと、つまり好感度を表すためです。反応の電圧が正の場合、反応は順方向に有利になり、自然に発生します。電圧が負の場合、反応は順方向に不利になり、自発的には起こりません。電圧と ΔG では符号が異なるため、これは少し混乱する可能性があります。ただし、換算表を見れば覚えやすいかもしれません。すべてのアルカリ金属と、亜鉛や鉄のような他の容易に酸化される金属は、電子を得るよりも失う方が好まれます.フッ素などの非金属や、酸化しにくい銅や銀などのさまざまな金属については、逆のことが当てはまります。これらの元素は、電子を獲得しやすくなります。
電気化学方程式
熱力学的変換
Eセル 、電圧は、自由エネルギー変化 ΔG と平衡定数 K
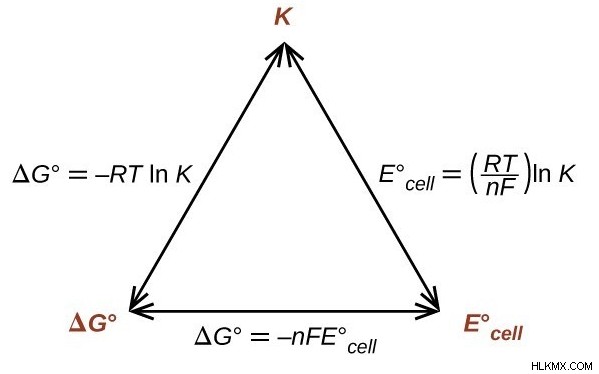
R:気体定数 (熱力学的形式)、8.314 J/mol*K に等しい
T:ケルビンの温度。
n:反応で移動した電子の数。
F:ファラデー定数、96485 C/mol 電子に等しい。
細胞の可能性
Eセル =E赤 + Eオックス =Eカソード – Eアノード
上記のカソード/アノードの式では、還元を使用します 両方の可能性。これは、アノードの電位が負になる可能性があることを意味します。酸化還元の式では、陰極に還元電位を使用し、陽極に反対の値 (酸化電位) を使用します。
ネルンストの式
電気化学でよく使われる式がもう 1 つあります。それがネルンストの式です。ここまでは、溶液中のイオン濃度は変化しないと仮定してきました。言い換えれば、標準状態でのセルの初期電位のみを扱ってきました。ただし、実際のバッテリーの還元イオンおよび/またはアノードは、最終的に使い果たされます。これは、電池が切れたときに起こることです。正極溶液に十分な陽イオンが残っていないか、反応が進行するのに十分な陽イオンが陽極溶液に多すぎます。ネルンストの式は、このような非平衡条件を扱います。ネルンスト方程式の使用に関する詳細な説明については、この記事を参照してください。
電気分解
電気分解は、電流を使用して、他の方法では発生しない反応を「強制」するプロセスです。この手法は、化合物の分解によく使用されます。例は、反応 2H2 です。 〇 → 2H2 + O2 これは、水から水素と酸素ガスという非常に有用な 2 つの分子を生成します。この分解は自然に起こるものではなく、比較的小さな電圧を加えるだけで容易に進行します。電気分解は、鉱石、海水、およびその他の一般的な物質からさまざまな分子を取得するために、幅広い産業用途に使用されています。電気分解と電解セルのセットアップの詳細については、チュートリアルを参照してください。
電気メッキ
通常のガルバニ電池では、還元半電池の陽イオンは陰極と一致します。それは、それらの陽イオンが金属として表面に沈着するためです。陽イオンは陰極と一致して、物をきれいに保ちます。ただし、陽イオンが一致しなければ、反応は問題なく進行します。金属陽イオンは中性金属の形に変換され、カソードの表面に堆積します。これを電気メッキといいます。このプロセスは、別のより弾力性のある金属の層の下にある金属を保護します。たとえば、銅の層は、鉄のような酸化しやすい金属が錆びるのを防ぎます。電気めっきは非常に一般的であり、金属を別の金属で覆うための非常に有用な技術であり、多くの用途で非常に役立ちます.
さらに読む
- 電気化学セル
- KSP – 溶解度積定数
- 定期的な傾向
- インタラクティブな周期表