主な違い – 水素化と還元
水素化反応と還元反応は、関連する化学プロセスです。水素化は還元の一種です。還元には、酸化数の減少、酸素の喪失、水素の獲得という 3 つの異なる定義があります。最も受け入れられる定義は、酸化数の減少です。 3 番目の定義 (水素を得る) は、水素化の定義に適合します。しかしながら、還元は水素化でない限り触媒を必要としないのに対し、水素化は本質的に触媒を必要とする。 これが主な違いです 水素化と還元の間。
対象となる主な分野
1.水素化とは
– 定義、メカニズム
2.リダクションとは
– 定義、説明、例
3.水素化と還元の関係
4.水素化と還元の違いは何ですか
– 主な相違点の比較
キーワード:触媒、水素化、ニッケル、酸化、酸化数、パラジウム、プラチナ、レドックス反応、還元、飽和、不飽和

水素化とは
水素化は、水素分子 (H2 )および別の化学種。水素化は、通常、ニッケル、パラジウム、白金、およびそれらの酸化物などの触媒の存在下で行われます。水素化は、化合物の還元と飽和に使用されます。水素化には 2 つのタイプがあります:
<オール>二重結合または三重結合で構成されるほぼすべての有機化合物は、触媒の存在下で水素分子と反応できます。水素化反応は工業合成プロセスにとって非常に重要です。たとえば、石油産業では、ガソリンやさまざまな石油化学製品の製造に水素化が使用されています。
水素化のメカニズム
水素化のメカニズムを考えるとき、考慮する必要がある 3 つの主な要素があります。それらは、不飽和基質、水素源、および触媒です。システムの温度と圧力は、使用する基質と触媒によって異なる場合があります。
多くの場合、水素源は水素ガスそのものです。加圧シリンダーで市販されています。水素化のための基質は、アルケン、アルキン、アルデヒド、アルコール、ケトン、エステル、カルボン酸およびニトロ化合物であり得る。触媒には、均一系触媒と不均一系触媒の 2 種類があります。均一系触媒と不均一系触媒の違いは、均一系触媒は基質を含む溶液に溶解するのに対し、不均一系触媒はその溶液に懸濁することです。

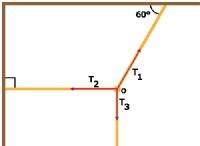
図 1:水素化のメカニズム
固体中で起こる水素化反応(不均一系触媒)は、Horiuti-Polanyi メカニズムによって説明されます。次の手順が記載されています。
<オール>しかし、均一系触媒作用を伴う水素化プロセスでは、金属が両方の成分に結合して中間アルケン金属(H)2を生成します。 複雑です。
削減とは
還元とは、化学種の酸化数を減らすことです。これは通常、電子の追加によって行われます。還元反応は、酸化還元反応において酸化反応と並行して起こる半反応です。酸化反応は酸化数を増やします。したがって、還元は酸化の反対です。
しかし、一部の反応では、酸化と還元はそれぞれ酸素の付加または除去を指します。ここで、酸化は酸素の獲得であり、還元は酸素の喪失です。酸化と還元のもう 1 つの古い定義には、水素の移動が含まれます。ここで、酸化は水素の喪失であり、還元は水素の獲得です。しかし、一般的に受け入れられている定義によれば、酸化は酸化状態の増加であることが知られていますが、還元は酸化状態の減少であることが知られています.
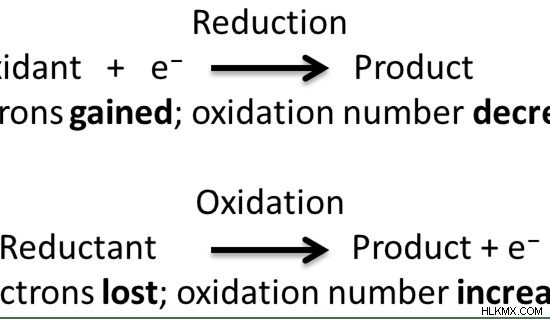
図 2:レドックス反応
減少は、次の 3 つの現象のいずれかである可能性があります。
<オール>例
還元反応の一般的な例:
- 鉄 (III) から鉄 (II) への還元:
- H から H2 への還元
- 銅から銅への還元
水素化と還元の関係
- 水素化は還元反応の一種です。還元の 3 つの定義の 1 つは、水素の獲得が還元であることを示しています。
水素化と還元の違い
定義
水素化: 水素化は、水素分子 (H2 ) と別の化学種。
削減: 還元とは、化学種の酸化数の減少です。
メカニズム
水素化: 水素化は本質的に水素の付加です。
削減: 還元は酸化数の減少です。酸素の損失;水素の獲得。
コンポーネント
水素化: 二重結合または三重結合を含む化合物は水素化されます。
削減: より高い酸化数を持つ化学種は還元を受けることができます.
触媒
水素化: 水素化には必須コンポーネントとして触媒が必要です。
削減: 還元反応は、水素添加でない限り触媒を必要としません。
結論
水素化は還元反応の一種です。不飽和化合物を飽和化合物に変換するために使用されます。還元とは、化学種の酸化数を減少させることを指します。それは常に酸化反応と並行して起こります。水素化と還元の主な違いは、水素化は本質的に触媒を必要とするのに対し、還元は水素化でない限り触媒を必要としないことです.
参照:
1.ヘルメンスティン、アン・マリー。 「化学における還元の定義」。
2. ThoughtCo、2017 年 9 月 3 日、こちらから入手可能。ライブラリテキスト。 「酸化と還元の定義」
3. Chemistry LibreTexts、Libretexts、2016 年 5 月 2 日、こちらから入手可能。 「水素化」ブリタニカ百科事典、ブリタニカ百科事典、2017 年 5 月 1 日、こちらから入手可能。
画像提供:
1. Wesleye1000 による「パラジウムの水素化を伴うメカニズム」 – Commons Wikimedia 経由の自著 (CC BY-SA 4.0)
2. 「Redox Halfs」Cameron Garnham 著 – Commons Wikimedia による自身の作品 (CC BY-SA 3.0)