気体の圧力と温度の関係は、Gay-Lussac の圧力温度の法則によって規定されています。この法則は、一定の体積に保持された固定質量のガスの圧力 (P) が、そのケルビン温度 (T) に方向的に比例することを示しています。したがって、特定のシステムの圧力が上昇すると、そのシステムの温度も上昇し、逆もまた同様です。気体の法則は、圧力、体積、温度、および量に関する気体の挙動を表します。気体は物質の状態の 1 つで、非常にきつく圧縮されているか、大きな空間を満たすために膨張しています。
対象となる主な分野
1.プレッシャーとは
– 定義、ガスの圧力
2.温度とは
– 定義、測定
3.圧力と温度の関係
– ゲイ・リュサックの法則
重要な用語:気体、ゲイ・リュサックの法則、ケルビン、圧力、温度

プレッシャーとは
圧力とは、物体に接触している物体によって物体に加えられる継続的な物理的な力です。単位面積あたりの力として計算されます。真空に囲まれたガスの密閉チャンバーを考えると、ガスによってチャンバーの壁に加えられる圧力は、3 つの要因に依存します。それらは、チャンバー内のガスの量、チャンバーの容積、およびガスの温度です。他のパラメータが一定の場合、チャンバー内の圧力はチャンバー内のガスの量に正比例します。チャンバーの容積に反比例します。チャンバー内のガスの温度に正比例します。圧力は 図 1 で定義されています。
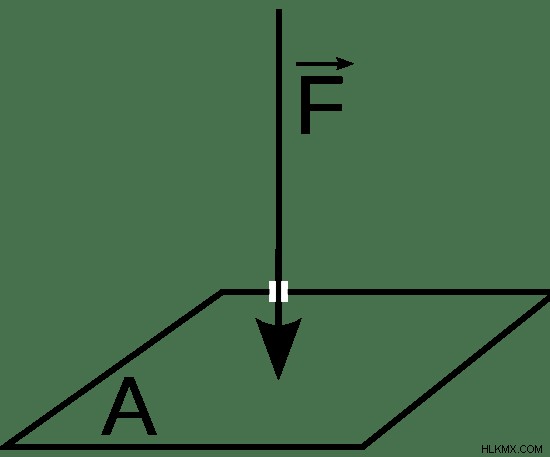
図 1:圧力
大気圧は、私たちの上の空気の重さによって作られます。海面では 10 Pa です。
温度とは
温度は、物質または物体に存在する熱の程度です。これは、特定のシステム内に含まれる内部エネルギーを表します。温度は、さまざまな測定単位で校正された温度計で測定できます。摂氏スケールは、温度を測定するために最も広く使用されているスケールで、°C で表されます。国際単位系 (SI) に基づく温度の単位はケルビン (K) です。 図 2 に温度計を示します。

図 2:温度計
理論上の最低温度である絶対零度では、物質中の粒子の熱運動は最小になります。絶対零度は 0 K で、-273.14 °C です。
圧力と温度の関係とは
圧力と温度の関係は、気体に関して説明されています。ゲイ・リュサックの法則は、圧力と温度の関係を説明する気体の法則です。それは、一定の体積で、特定の量の特定のガスの圧力がそのケルビン温度に正比例すると述べています。次のように記述できます:
- P ∝ T、または
- P/T =k (k は定数)、または
- P1 /T1 =P2 /T2
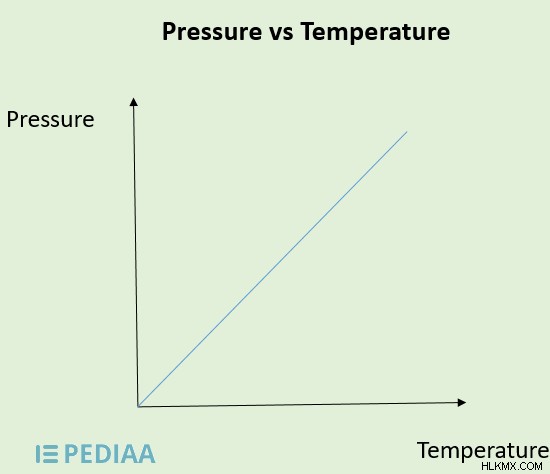
図 3:圧力と温度の関係
特定のシステムの温度が上昇すると、ガス内の分子の動きが速くなり、ガス容器の壁により大きな圧力がかかります。これにより、システムの圧力が増加します。システムの温度が低下すると、圧力が低下します。したがって、一定の体積では、特定のガスの圧力は温度に正比例します。
結論
一定量のガスの圧力は、一定量の温度に正比例します。システムの温度が上昇すると、圧力も上昇し、逆もまた同様です。気体の圧力と温度の関係は、ゲイ・リュサックの法則によって規定されています。
参照:
1. 「9.2 圧力、体積、量、および温度の関係:理想気体の法則」。 化学 、ここから入手できます。
画像提供:
1.「圧力領域」Klaus-Dieter Keller – Commons Wikimedia 経由の自作 (CC BY-SA 3.0)
2. 「1134182」(CC0)Pixabay経由