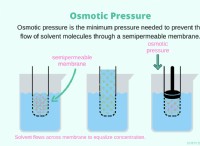
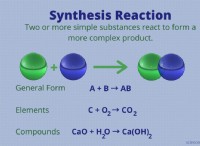
これがそれがどのように機能するかの内訳です:
1。エネルギーレベル(K、L、M、N ...):
* 主要な量子数(n): 各ブロックはエネルギーレベル(電子シェルとも呼ばれます)を表します。 nの値が高いほど、電子は核から遠くなり、そのエネルギーが高くなります。
* k(n =1)、l(n =2)、m(n =3)、n(n =4)...: これらの文字は、異なるエネルギーレベルに対して単に速記です。
2。 Sublevels(S、P、D、F):
* 角運動量量子数(l): 各エネルギーレベル内に、さまざまな形とエネルギーを特徴とするサブレベルがあります。
* s(l =0): 球形、各エネルギーレベル内で最も低いエネルギー。
* p(l =1): ダンベルの形状、sよりわずかに高いエネルギー。
* d(l =2): より複雑な形状、pよりも高いエネルギー。
* f(l =3): さらに複雑な形状、各エネルギーレベル内で最高のエネルギー。
それが周期表にどのように関連するか:
* 期間: 周期表の各行(期間)は、特定のエネルギーレベル(k、l、mなど)に対応します。したがって、同じ列のすべての要素は、最も外側の電子に対して最も高いエネルギーレベルを持っています。
* グループ: 周期表の各列(グループ)は、特定のsublevel(s、p、d、f)に対応しています。同じグループの要素には、同じ数の価電子(最も外側のサブレベルの電子)があります。
* ブロック: サブレベルに基づいた周期表の要素の配置は、ブロック分類と呼ばれます :
* s-block: 最初の2つの列(グループ1および2)は、最も外側の電子がSサブレベルにある要素で構成されています。
* pブロック: 最後の6つの列(グループ13から18)には、Pサブルベルに最も外側の電子がある要素が含まれています。
* d-block: 中央の10列(グループ3〜12)は、Dサブレベルに最も外側の電子を持つ要素を含んでいます。
* fブロック: 周期表の下部にある2列(ランタニドとアクチニド)は、Fサブルベルの最も外側の電子を備えた要素です。
なぜこの分類が重要ですか?
* 化学的特性の予測: 同じブロック内の元素は、特に価電子の電子に類似した電子構成を持っているため、同様の化学的特性を持っています。
* 定期的な傾向を理解する: ブロック分類は、定期テーブル全体の原子サイズ、イオン化エネルギー、電気陰性度、およびその他の特性の傾向を説明するのに役立ちます。
* 電子構成と結合: 要素の電子構成を知ることで、それが他の要素と結合し、異なる化合物を形成する方法を予測することができます。
要約すると、K L M NブロックとS P D Fサブブロックは、電子構成に基づいて要素の挙動を整理して理解するために不可欠です。この分類システムは、化学的特性を予測し、周期表での役割を理解するためのフレームワークを提供します。