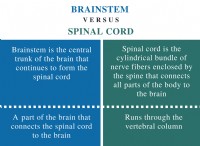
* 電気陰性度: 原子には異なる電気性があり、これが電子を引き付ける傾向です。この違いは、さまざまな種類の結合の形成を促進します。
* 価電子: 原子が形成できる結合の数を決定します。
* 結合設定: 一部の原子は、電子構造と反応性により、特定の種類の結合を形成することを強く好む。
これは、債券の主要なタイプの内訳と、それに影響を与える要因です。
1。イオン結合:
* 層: 金属(電気陰性度が低い)と非金属(高い電気陰性度)の間で発生します。金属原子は電子を失い、正の帯電イオン(陽イオン)を形成しますが、非金属原子は電子を摂取して負に帯電したイオン(アニオン)を形成します。これらの反対に帯電したイオン間の静電引力は、結合を形成します。
* 例: ナトリウム(Na)および塩素(Cl)はイオン結合を形成して、塩化ナトリウム(NaCl)またはテーブル塩を作ります。
2。共有結合:
* 層: 電子を共有する2つの非金属(同様の電気陰性度)の間で発生します。
* タイプ:
* 非極性共有結合: 電子は原子間で等しく共有されます。これは、電気陰性度の違いが非常に小さいときに起こります。
* 極性共有結合: 電子は、電気陰性度の違いにより、原子間で不均等に共有されます。これにより、1つの原子に部分的な正電荷が生成され、他の原子に部分的な負電荷が生成されます。
* 例: 2つの塩素原子(CL)は、塩素分子(Cl2)に非極性共有結合を形成します。酸素と水素は、水分子(H2O)に極性共有結合を形成します。
3。金属債:
* 層: 金属原子間で発生します。価電子は非局在化され、金属格子全体で自由に移動します。電子のこの自由な動きは、金属原子の間に強い引力を生み出します。
* 例: 銅(Cu)原子は、銅線に金属結合を形成します。
4。水素結合:
* 層: 高強性原子(酸素や窒素など)と別の電気陰性原子に共有結合した水素原子の間の特別なタイプの分子間力。
* 例: 水分子は互いに水素結合を形成します。
要約:
*すべての原子がすべての種類の結合を形成できるわけではありません。
*形成される結合のタイプは、関与する原子、原子価電子の数、および原子の特定の結合設定の間の電気陰性度の差に依存します。