原子番号だけでは不十分な理由
* 電子構成: 反応性は、主に安定した電子構成を実現したい要素の要素(通常は完全な外側シェル)によって駆動されます。原子数はプロトンの数を教えてくれますが、電子の配置を直接明らかにしません。
* 価電子: 最も外側のシェル(価電子)の電子は、化学結合、したがって反応性に関与する電子です。原子番号は、要素がいくつの価電子を持っているかを直接伝えません。
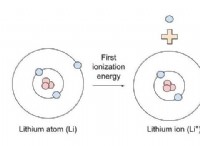
* イオン化エネルギーと電子親和性: 電子の除去または獲得の容易さに関連するこれらの特性は、反応性の主要な要因です。これらは、原子数だけで直接決定されない電子シールド、核電荷、電子シェルの数などの要因の影響を受けます。
原子数との反応性を考慮する方法
1。定期的な傾向: 反応性を理解するためには、原子数は、周期表の要素の位置を決定するため、理解するために重要です。これにより、定期的な傾向を使用できます。
* 期間(左から右)にわたって: 電気陰性度は一般に増加します。つまり、要素は電子を獲得する可能性が高くなり、非金属としてより反応的になります。
* グループ(上から下): 電気陰性度は一般に低下します。つまり、要素は電子を失う可能性が高くなり、金属としてより反応的になります。
2。価電子: 価電子電子の数を理解することが不可欠です。これは、要素のグループ番号に基づいて予測できます(いくつかの例外を除いて)。たとえば、グループ1(アルカリ金属)の元素は1原子価電子を持ち、非常に反応性がありますが、グループ18(Nobleガス)の元素は完全な外側シェルを持ち、一般的には反応性がありません。
3。その他の要因:
* メタリック対非金属文字: 金属は電子を失う傾向があり、非金属とは異なる方法で反応します。これは電子を獲得する傾向があります。
* イオン化エネルギー: イオン化エネルギーが低いほど、電子を除去しやすくなり、元素がより反応します。
* 電子親和性: 電子の親和性が高いほど、要素が電子を獲得する可能性が高くなり、より反応性が高くなります。
例
元素ナトリウム(NA)と塩素(CL)を見てみましょう。
* ナトリウム(Na): アトミック番号11。1原子価電子を持ち、安定した構成を実現するためにこの電子を容易に失うため、高反応性(金属)です。
* 塩素(cl): 原子番号17。7つの原子価電子があり、外側のシェルを完成させるために電子を容易に獲得するため、高度に反応性(非金属)もあります。
結論:
原子数は出発点ですが、定期的な傾向、価電子の構成、およびイオン化エネルギー、電子親和性などの他の要素を考慮して、元素の反応性を正確に評価する必要があります。