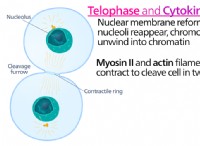
価電子と反応性
* 価電子: これらは、原子の最も外側の殻の電子です。彼らは化学結合に関与しているものです。
* 安定性: 原子は安定した電子構成を努力し、多くの場合、完全な外側シェル(通常8電子)を備えた貴族(グループ18)に似ています(グループ18)。
* 反応性: 電子電子が少ない元素は、より反応的になる傾向があり、安定性を実現するために電子を獲得または共有しようとします。ほぼ完全な外側のシェルを備えた元素も反応性があり、電子を失うことを求めています。
7価電子を持つ要素
7価電子を持つ要素は、完全な外側のシェル(この場合はNeon、Neon)から1つの電子です。 それは非常に反応的であり、その外側のシェルを完成させるために1つの電子を *獲得する可能性があります。
他の要素の価電子
他の要素が持つべき原子価電子の数を判断するには、これらの可能性を考慮してください。
* イオン結合: 7つの電子を持つ要素は、おそらく電子を獲得し、負イオン(アニオン)を形成します。他の要素は、正のイオン(陽イオン)になり、安定したイオン結合を形成するために1つの電子を失う必要があります。これは、他の元素が1原子価電子(リチウムやナトリウムなどのグループ1金属)を持つ必要があることを意味します。
* 共有結合: 7つの電子を持つ要素は、1つの電子を別の要素と共有し、共有結合を形成することができます。他の要素は、共有ペアに1つの電子を寄付できます。 これは、他の要素が1、3、5、または7つの価電子を持つことができることを意味します。
例:
* イオン結合: イオン結合により、ナトリウム(1価電子)と塩素(7価電子)が塩化ナトリウム(NaCl)を形成します。
* 共有結合: 共有結合により、塩素(7価電子)と水素(1原子価電子)は塩化水素(HCl)を形成します。
要約
7価電子を持つ元素は、イオン結合を通じて1つの電子(グループ1のような)を簡単に失う可能性のある要素と最も容易に反応します。また、1つの電子を共有できる要素と共有結合を形成することもできます。