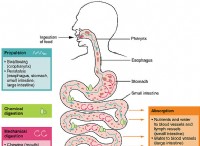
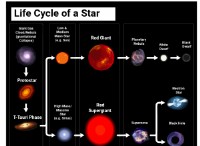
これが故障です:
* 可逆反応: 製品が反応して反応物を再び形成できる化学反応。
* 平衡: 前方反応と逆反応の速度が等しく、反応物と生成物の濃度が時間の経過とともに一定のままである状態。
平衡定数kは次のように定義されています。
k =(製品) /(反応物)
ここで:
* 製品: 製品の濃度(または部分的圧力)は、バランスのとれた化学式の化学量論係数に上昇しました。
* 反応物: 反応物の濃度(または部分的圧力)は、それらの化学量論係数に上昇しました。
例:
反応のために:
aa +bb⇌Cc + dd
平衡定数は次のとおりです。
k =([c]^c * [d]^d) /([a]^a * [b]^b)
kの価値は何を教えてくれますか?
* k> 1: この反応は、平衡状態での製品の形成を支持します。平衡状態では反応物よりも多くの製品があります。
* k <1: 反応は、平衡状態での反応物の形成を支持します。平衡状態の製品よりも多くの反応物があります。
* k =1: 反応はバランスが取れているため、生成物と反応物の濃度は平衡状態でほぼ等しくなります。
重要なメモ:
*平衡定数は温度依存量です。
* Kの単位は、特定の反応と濃度の表現方法に依存します。
* Kは、反応の方向と製品形成の程度を予測するための強力なツールです。
もっと詳細な説明や具体的な例が必要な場合はお知らせください!