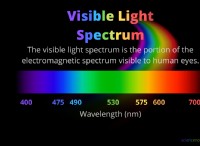
概念を理解する
* 蒸発のエントロピー(ΔSvap): これは、物質が液体からガスに移行する場合のエントロピーの変化です。分子の障害またはランダム性の増加を表しています。
* 蒸発のエンタルピー(ΔHvap): これは、沸点で1モルの物質を蒸発させるために必要なエネルギーの量です。
* 沸点: 液体の蒸気圧が周囲の大気圧に等しい温度。
方程式
エンタルピー変化(ΔHVAP)、エントロピー変化(ΔSVAP)、および沸点(t)の関係は、次の方程式で与えられます。
ΔSvap=ΔHvap / t
重要な注意: 温度(t)はケルビンにある必要があります!
計算
1。沸点をケルビンに変換:
T =78.5°C + 273.15 =351.65 K
2。方程式に値を差し込みます:
ΔSvap=109.8 j / mol・k / 351.65 k
3。蒸発のエントロピーを計算します:
ΔSVAP≈0.312j/mol・k
回答: エタノールのモルあたりの気化のエントロピーは、約 0.312 j/mol・k です 。