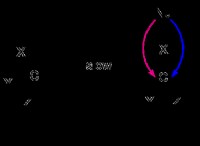
電気陰性度とは?
電気陰性度は、原子が化学結合に電子を引き付ける能力です。 それを原子間の「綱引き」と考えてください。
イオン結合がどのように形成されるか:
1。電子の伝達: イオン結合では、1つの原子(通常は金属)が1つ以上の電子を「失い」、正に帯電したイオン(陽イオン)になります。他の原子(通常は非金属)はこれらの電子を「獲得」し、負に帯電したイオン(アニオン)になります。
2。静電引力: 反対に帯電したイオンは、静電力のために互いに強く引き付け、イオン結合を形成します。
イオン結合の重要な特徴:
* 高融点と沸点: 強い静電力は、壊れるのに多くのエネルギーを必要とします。
* 通常、室温で固体: イオンによって形成される剛性構造を破壊することは困難です。
* 溶融状態または溶解状態の電気の良い導体: 溶けたり溶けたりすると、イオンは自由に移動できるようになり、電気を導くことができます。
* 一般に、水のような極性溶媒に溶けます: 水の極性は、荷電イオンと相互作用し、イオン結合を破壊し、化合物を溶解することができます。
例:
塩化ナトリウム(NaCl)、一般的なテーブル塩は、イオン化合物の例です。ナトリウム(Na)は電子を失い、Na+になりますが、塩素(Cl)は電子を獲得してCl-になります。これらの反対に帯電したイオンは互いに引き付けられ、イオン結合が形成されます。
要約:
イオン結合は、大きな電気陰性度の違いを持つ原子の間に形成され、電子の伝達、反対に帯電したイオンの形成、およびそれらの間の強い静電引力をもたらします。これは、溶融または溶解したときの高い融点と良好な電気伝導率などの特徴的な特性を持つ化合物につながります。