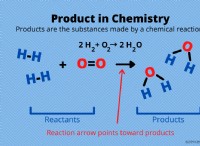
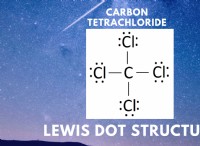
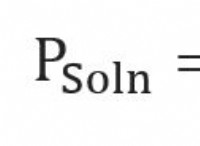1。用語の理解
* 経験式: 化合物中の原子の最も単純な全自由比。存在する各要素の相対的な割合を教えてくれます。
* 分子式: 分子に存在する各元素の原子の実際の数。分子の正確な組成を示しています。
2。経験式の決定
手順:
1。割合をグラムに変換: 質量ごとに割合が与えられている場合は、100 gのサンプルを想定してください。これは、割合がグラムに直接変換されることを意味します。
2。グラムをモルに変換: 各要素の質量をそのモル質量(周期表にあります)で除算して、モル数を取得します。
3。最も単純な全自由比を見つけます: それぞれのモル値を最小のモル値で分割します。これらの結果を最も近い整数に丸めます。これらの整数は、経験式の添え字を表しています。
例: 化合物は、質量で85.7%の炭素と14.3%の水素であることがわかります。
* 100 g:を想定します 85.7 g cおよび14.3 g h
* ほくろ:
* C:85.7 g / 12.01 g / mol =7.14 mol c
* H:14.3 g / 1.01 g / mol =14.2 mol h
* 比:
* C:7.14 mol / 7.14 mol =1
* H:14.2 mol / 7.14 mol =2
* 経験式: ch₂
3。分子式の決定
手順:
1。経験的式の質量を計算します: 経験式に原子の原子質量を加えます。
2。分子量を決定します: 通常、分子量が与えられます。そうでない場合は、質量分析などの実験技術を使用できます。
3。分子量と経験式質量の比率を見つけます: 分子量を経験的な式の質量で除算します。
4。経験式のサブスクリプトにステップ3で見つかった比率を掛けます: これにより、分子式が得られます。
例: 前の例の化合物の分子量が56 g/molであるとしましょう。
* 経験式質量: ch₂=12.01 g/mol +(2 * 1.01 g/mol)=14.03 g/mol
* 比: 56 g/mol/14.03 g/mol≈4
* 分子式: ch₂ * 4 =c₄h₈
キーポイント:
* 経験式化合物の組成の最も単純な表現を提供します。
* 分子式分子内の原子の実際の数を与えます。
* 経験的式と分子式が同じ場合、化合物は原子の単純な全文比を持っています。
別の例を挙げたい場合はお知らせください!