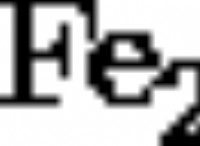1。陽イオンの形成:
*元々11個のプロトンと11個の電子を搭載したナトリウム原子は、現在11個のプロトンと10個の電子のみを持っています。
*これは、電子よりも多くの陽子があるため、全体的な正電荷になります。
*この正に帯電したナトリウム原子は現在、ナトリウムイオン(Na+)と呼ばれています
2。安定性:
*電子を失うと、ナトリウム原子の外側のエネルギーシェルが満たされ、安定します。
*ナトリウムの電子構成(1S²2S²2P⁶3S¹)は、完全な外側シェルを持ち、非常に安定しているネオン(1S²2S²2P⁶)の電子構成になります。
3。反応性:
*ナトリウムイオンは非常に反応性があります。それらは、負に帯電したイオンまたは分子を引き付ける傾向があり、イオン結合を形成します。
*これが、ナトリウムが塩素のような元素と容易に反応し、テーブル塩である塩化ナトリウム(NaCl)を形成する理由です。
要約:
その外殻から電子を失うと、中性ナトリウム原子を積極的に帯電したナトリウムイオン(Na+)に変換します。これはより安定して高度に反応します。このプロセスは、イオン化合物の形成における基本原則です。