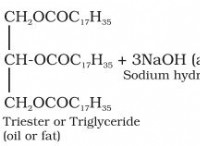enolフォームを支持する要因:
* 共役: ジカルボニル化合物は、エノール形態の場合、高度に共役システムを形成できます。エノールの二重結合はカルボニル基と結合し、電子の非局在化と安定性の増加をもたらします。これは、β-ジケトンやβ-ケトエステルなどの1,3-ジカルボニル化合物で特に顕著です。
* 分子内水素結合: ENOL形態は、分子内水素結合に関与し、分子をさらに安定させることができます。ヒドロキシル基に付着した水素原子は、カルボニル基の酸素原子との強い結合を形成します。
* 立体効果: ENOL形式は、ケト形式と比較して立体障害の減少のために時々好まれる可能性があります。これは、カルボニル基の近くにかさばる置換基が存在する場合に特に当てはまります。
ケトフォームを支持する要因:
* 熱力学的安定性: 場合によっては、ケト形式は単に熱力学的に安定しています。 これは、ケト形式の炭素酸素結合が強いような要因による可能性があります。
* 静電効果: ケト形式は、カルボニル基の偏光により、より強い静電相互作用の恩恵を受けることがあります。
例:
* β-ジケトン: β-ジケトンでは、エノール型は、強い結合と分子内の水素結合により、ほとんど常に好ましい互変異性体です。
* アセチルアセトン: この化合物は、ほぼ完全に溶液中のエノール形式に存在します。
重要なメモ:
* 平衡: ケトとエノールの形態は平衡状態に存在します。この平衡の位置は、各互変異性体の相対量を決定します。
* 条件: 一方の互変異性体よりも優先順位は、溶媒、温度、触媒の存在などの要因に依存する可能性があります。
結論:
結合や水素結合などの要因により、エノール形態はジカルボニル化合物で好まれることがよくありますが、特定の分子と周囲の条件に応じて、ケト形式も好まれます。 特定の状況で支配的な互変異性体を決定するために、すべての関連要因を考慮することが不可欠です。