解決策:
* 一般用語: 解は、2つ以上の物質の均質な混合物です。
* コンポーネント: 溶液は、溶質(溶解する物質)と溶媒(溶解する物質)で構成されています。
* 例: 砂糖を水に溶解し、塩を水に溶解し、空気(互いに溶解したガス)。
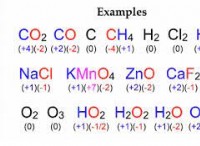
塩酸(HCl):
* 特定の化合物: 塩酸は特定の化合物です。水素(H)と塩素(Cl)原子で構成される強酸です。
* 酸性特性: HClは容易に水に溶解し、非常に酸性の溶液を形成します。
* 使用: プラスチック、医薬品、クリーニング製品の生産など、多くの産業プロセスで使用されています。
重要な違い:
* 特異性: 溶液は一般的な用語であり、塩酸は特定の化合物です。
* 構成: 溶液は物質のさまざまな組み合わせから作ることができますが、塩酸は常に水素と塩素で構成されています。
* 酸性度: 塩酸は常に酸性ですが、溶液はその成分に応じて酸性、塩基性、または中性です。
アナロジー:
一杯のコーヒーを想像してみてください。コーヒーは *ソリューション *です。なぜなら、それは水に溶けたコーヒー張り(溶質)の均一な混合物(溶媒)だからです。 特定の量の塩酸をコーヒーに追加すると、HClの存在のために *酸性 *である *溶液 *を作成しました。
要するに、塩酸は溶液の一種ですが、すべての溶液が塩酸であるわけではありません。